题目内容
10.如图是C60的分子模型、金刚石和干冰的晶体模型.请回答下列问题: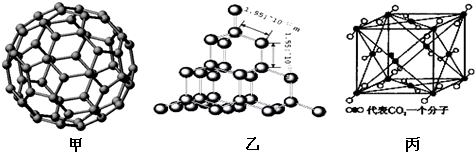
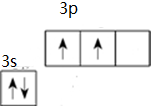
(1)硅与碳同主族,写出基态硅原子的价电子排布图
 .
.(2)上述三种物质的熔点由高到低的顺序是金刚石>C60>干冰,理由是金刚石属于原子晶体熔点最高,C60和干冰属于分子晶体,C60的相对分子质量大,范德华力强,熔点高.
(3)二氧化硅结构跟金刚石结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子.观察图乙中金刚石的结构,分析二氧化硅的空间网状结构中,Si、O原子形成的最小环上O原子的数目是6,1mol二氧化硅晶体中Si-O键的数目为4NA.
(4)如图丙是干冰的晶胞模型,1个CO2分子周围距离最近的CO2分子有12个.
分析 (1)Si原子核外有14个电子,3s、3p电子为其价电子,根据构造原理书写其价电子排布图;
(2)原子晶体熔沸点最高,分子晶体熔沸点与分子间作用力成正比,分子间作用力与其相对分子质量成正比;
(3)二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子,硅晶体中每个最小环上是6个Si原子,据此计算O原子个数;二氧化硅晶体中,每个Si原子形成Si-O键个数是4,据此计算1mol二氧化硅中Si-O键个数;
(4)1个CO2分子周围距离最近的CO2分子个数=3×8×12.
解答 解:(1)Si原子核外有14个电子,3s、3p电子为其价电子,根据构造原理书写其价电子排布图 ,
,
故答案为: ;
;
(2)金刚石属于原子晶体熔点最高,C60和干冰属于分子晶体,C60的相对分子质量大,范德华力强,熔点高,所以晶体熔沸点高低顺序是金刚石>C60>干冰,
故答案为:金刚石>C60>干冰;金刚石属于原子晶体熔点最高,C60和干冰属于分子晶体,C60的相对分子质量大,范德华力强,熔点高;
(3)二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子,硅晶体中每个最小环上是6个Si原子,所以Si、O原子形成的最小环上O原子的数目是6;二氧化硅晶体中,每个Si原子形成Si-O键个数是4,所以1mol二氧化硅中Si-O键个数为4NA,
故答案为:6;4NA;
(4)1个CO2分子周围距离最近的CO2分子个数=3×8×12=12,故答案为:12.
点评 本题考查晶胞计算、晶体熔沸点高低判断、原子核外电子排布等知识点,这些都是高频考点,侧重考查空间想象能力和计算能力,难点是配位数的计算方法,熟记金刚石、硅、二氧化硅晶体中最小环上原子个数,为易错点.

表1 部分阳离子以氢氧化物形式完全沉淀时的pH
| 沉淀 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 11.2 |
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4•7H2O | 30.9 | 35.5 | 40.8 | 45.6 | -- |

根据以上流程图并参考表格pH和溶解度数据,试回答下列问题:
(1)硼镁泥加入浓硫酸时,FeO发生的变化是bc(选填序号).
a.被钝化 b.被氧化 c.被溶解
(2)过滤1的滤液中加入硼镁泥,调节溶液的pH=5-6,再加入NaCLO溶液加热煮沸,其目的有:①将溶液中的Mn2+氧化成MnO2,该反应的离子方程式为Mn2++ClO-+H2O=MnO2↓+2H++Cl-.②将Fe2+氧化为Fe3+,该反应的离子方程式为6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-或2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(3)沉淀B中除MnO2、SiO2外还含有Fe(OH)3、Al(OH)3等物质(填化学式)
(4)沉淀C的化学式是CaSO4•2H2O或CaSO4,过滤Ⅲ需趁热过滤的理由是防止MgSO4在温度降低时结晶析出.

| A. | 该晶体属于离子晶体 | |
| B. | 晶体的化学式为BaO2,所以晶体中阴阳离子个数比1:2 | |
| C. | 若将晶胞中阴阳离子位置互换,其图形依然可以看作该晶体的晶胞结构图 | |
| D. | 与每个Ba2+距离相等且最近的Ba2+共有12个 |
| A. | v=0.10 mol•L-1•s-1是指1 s内某物质的物质的量浓度为0.10 mol•L-1 | |
| B. | 对于任何化学反应来说,反应速率越快,反应现象就越明显 | |
| C. | 化学反应速率只是对可逆反应才适用 | |
| D. | 根据反应速率的大小,可以知道反应进行的相对快慢 |
| A. | 食盐、氯化钾等晶体易溶于水 | |
| B. | 氯气在加压、降温时会变成液氯或固氯 | |
| C. | 融化的铁水降温可铸成铁锭 | |
| D. | 金刚石有相当大的硬度 |
| A. | 原子半径 A>B>D>C | B. | 原子序数 d>c>b>a | ||
| C. | 离子半径 C>D>B>A | D. | 单质的还原性 A>B>D>C |

 ;
; (其中两种)(任意两种)
(其中两种)(任意两种)
 ,该反应的反应类型是取代反应.
,该反应的反应类型是取代反应. )的路线如下图所示:
)的路线如下图所示:
 +3NaOH
+3NaOH +NaCl+2H2O;
+NaCl+2H2O;  ,写出其余的同分异构体的结构简式
,写出其余的同分异构体的结构简式 、
、 .
.