题目内容
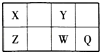
【题目】在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)2Z(g),此反应达到平衡的标志是( )
A.容器内气体密度不随时间变化
B.v(X):v(Y)=1:2
C.容器内X、Y、Z的浓度不随时间变化
D.单位时间消耗0.1molX同时生成0.2molZ
【答案】C
【解析】解:A、容器内气体密度= ![]() ,反应混合物都为气体,根据质量守恒,混合气体的总质量不变,体积为定值,密度自始至终不变,不能说明到达平衡状态,故A错误; B、自反应开始v(X)为v(Y)的
,反应混合物都为气体,根据质量守恒,混合气体的总质量不变,体积为定值,密度自始至终不变,不能说明到达平衡状态,故A错误; B、自反应开始v(X)为v(Y)的 ![]() 倍,所以v(X):v(Y)=l:2,不能说明达平衡,故B错误;
倍,所以v(X):v(Y)=l:2,不能说明达平衡,故B错误;
C、容器内X、Y、Z的浓度不随时间变化,说明反应达到平衡,故C正确;
D、单位时间消耗0.1molX同时生成0.2molZ,说明反应v正(X)=2v正(Y) , 不能说明达平衡,故D错误;
故选:C.
【考点精析】利用化学平衡状态的判断对题目进行判断即可得到答案,需要熟知状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等.

练习册系列答案
相关题目
【题目】如图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的组合是( )
M | N | P | |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |

A.A
B.B
C.C
D.D