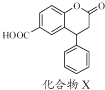
题目内容
【题目】以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如图1: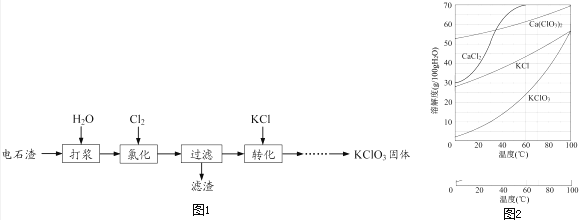
(1)氯化过程控制电石渣过量,在75℃左右进行.氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2 , 少量Ca(ClO)2 分解为CaCl2和O2 .
①生成Ca(ClO)2的化学方程式为 .
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有(填序号).
A.适当减缓通入Cl2速率 B.充分搅拌浆料 C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2 转化为Ca(ClO3)2的总反应方程式为:
6Ca(OH)2+6Cl2═Ca(ClO3)2+5CaCl2+6H2O
氯化完成后过滤.
①滤渣的主要成分为(填化学式).
②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2]:n[CaCl2]1:5(填“>”、“<”或“=”).
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3 , 若溶液中KClO3的含量为100gL﹣1 , 从该溶液中尽可能多地析出KClO3固体的方法是 .
【答案】
(1)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;AB
(2)CaCO3、Ca(OH)2;<
(3)蒸发浓缩、冷却结晶
【解析】电石渣含有Ca(OH)2 , 加入水打浆,通入氯气,可生成Ca(ClO)2 , Ca(ClO)2进一步转化为Ca(ClO3)2 , 过滤后在滤液中加入KCl转化生成KClO3 , 经蒸发浓缩、冷却结晶可得晶体KClO3。
(1)①氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
②提高Cl2转化为Ca(ClO3)2的转化率,可使氯气和氢氧化钙充分接触,可适当减缓通入Cl2速率、充分搅拌浆料,因氢氧化钙微溶于水,加水溶解的做法不可取,因浓度过低,对后续实验不利,故答案为:AB;
(2)①发生6Ca(OH)2+6Cl2═Ca(ClO3)2+5CaCl2+6H2O,生成的Ca(ClO3)2溶于水,CaCO3不溶于水,Ca(OH)2微溶,则滤渣中含有CaCO3、Ca(OH)2 , 故答案为:CaCO3、Ca(OH)2;
②氯化过程中Cl2与氢氧化钙反应部分生成Ca(ClO)2和CaCl2 , 则n[Ca(ClO3)2]:n[CaCl2]<1:5,故答案为:<;
(3)该溶液中尽可能多地析出KClO3固体,应经蒸发浓缩、冷却结晶,故答案为:蒸发浓缩、冷却结晶.
本题考查物质的制备,为高考常见题型和高频考点,侧重于考查学生的分析、实验能力,解答本题注意把握物质的性质以及题给信息,把握反应的流程,同时要具有扎实的实验基础知识,难度不大.

 名校课堂系列答案
名校课堂系列答案【题目】从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O.
(1)为了加快反应速率,不可以采取的措施有(填序号,下同). A.使用催化剂 B.提高氧气的浓度
C.提高反应的温度 D.降低反应的温度
(2)已知该反应为放热反应,如图能正确表示该反应中能量变化的是 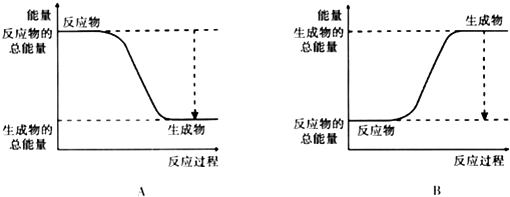
(3)从断键和成键的角度分析上述反应中能量的变化.已知化学键的键能如表:
化学键 | H﹣H | O=O | H﹣O |
键能kJmol﹣1 | 436 | 496 | 463 |
由此计算2mol H2在氧气中燃烧生成气态水放出的热量 .