题目内容
【题目】某试液中只可能含有下列K+、NH4+、Fe2+、Al3+、Cl﹣、SO42﹣、CO32﹣、AlO2﹣ 中的若干种离子,离子浓度均为0.1molL﹣1 . 某同学进行了如图实验: 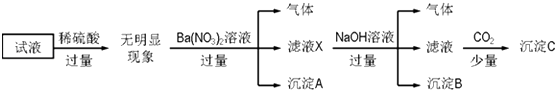
(1)根据实验现象判断,滤液X中大量存在的阳离子有;
(2)沉淀A的化学式;沉淀B的化学式;
(3)沉淀C的成分(填“能”或“不能”)确定.若能确定,写出化学式;若不能,说明理由 .
(4)该溶液中一定存在的离子是;一定不存在的离子是 .
【答案】
(1)NH4+、Fe3+和Ba2+
(2)BaSO4;Fe(OH)3
(3)能;BaCO3;﹣
(4)NH4+、Fe2+、Cl﹣、SO42﹣;Al3+、K+、AlO2﹣、CO32﹣
【解析】解:加入过量稀硫酸无明显变化,说明无碳酸根离子,无Ba2+ , 无AlO2﹣;加入硝酸钡有气体,因为前面已经加入了硫酸,硝酸根离子在酸性条件下具有强氧化性,说明有亚铁离子存在且被氧化,沉淀为硫酸钡;加入NaOH有气体,说明存在铵根离子,气体氨气,沉淀B为红褐色氢氧化铁沉淀;通入少量CO2产生沉淀,先与OH﹣、Ba2+反应,沉淀C为碳酸钡,不能说明存在Al3+ . 因为存在的离子浓度均为0.1molL﹣1 , 从电荷的角度出发,只能含有NH4+、Fe2+、Cl﹣、SO42﹣才能保证电荷守恒,则原溶液中一定不存在K+ , (1)依据分析可知:滤液X中大量存在的阳离子有NH4+、Fe3+和Ba2+ , 所以答案是:NH4+、Fe3+和Ba2+;(2)根据分析可知,沉淀A为BaSO4 , 沉淀B为Fe(OH)3 , 所以答案是:BaSO4;Fe(OH)3;(3)沉淀C为二氧化碳与钡离子、氢氧根离子反应生成的碳酸钡沉淀,化学式为BaCO3 , 所以答案是:能;BaCO3;(4)溶液中一定存在的离子为:NH4+、Fe2+、Cl﹣、SO42﹣ , 一定不存在的离子为:Al3+、K+、AlO2﹣、CO32﹣ , 所以答案是:NH4+、Fe2+、Cl﹣、SO42﹣;Al3+、K+、AlO2﹣、CO32﹣ .

【题目】从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O.
(1)为了加快反应速率,不可以采取的措施有(填序号,下同). A.使用催化剂 B.提高氧气的浓度
C.提高反应的温度 D.降低反应的温度
(2)已知该反应为放热反应,如图能正确表示该反应中能量变化的是 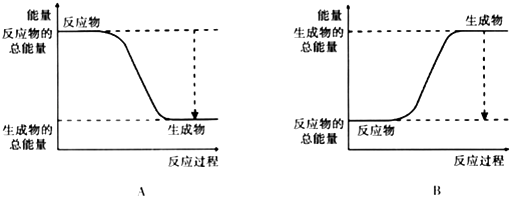
(3)从断键和成键的角度分析上述反应中能量的变化.已知化学键的键能如表:
化学键 | H﹣H | O=O | H﹣O |
键能kJmol﹣1 | 436 | 496 | 463 |
由此计算2mol H2在氧气中燃烧生成气态水放出的热量 .