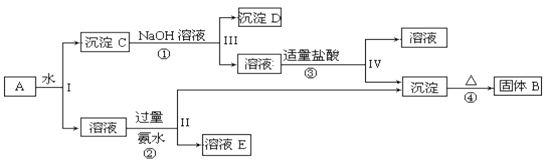
题目内容
【题目】现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的简单离子中半径最小 |
(1)写出这四种元素的元素符号:T_______;X_______;Y_______;Z_______。
(2)写出元素T的原子结构示意图_____________________________
(3)元素Y与元素Z相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是__________(填序号)。
①Y单质的熔点比Z单质低 ②Y的化合价比Z低
③Y单质与水反应比Z单质剧烈 ④Y最高价氧化物的水化物的碱性比Z强
(4)X元素的气态氢化物与其最高价含氧酸反应的方程式为______________________
(5)元素T和氢元素以原子个数比1∶1化合形成化合物Q,元素X与氢元素以原子个数比1∶2化合形成常用作火箭燃料的化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式________________________________________
【答案】O N Na Al ![]() Na ③④ NH3+HNO3=NH4NO3 N2H4+2H2O2=N2+4H2O
Na ③④ NH3+HNO3=NH4NO3 N2H4+2H2O2=N2+4H2O
【解析】
T原子最外层电子数是次外层电子数的3倍,由最外层电子数不超过8个可知T原子最外层电子数为6,则T是O元素;X常温下单质为双原子分子,分子中含有3对共用电子对,则X为N元素;Y元素M层比K层少1个电子, Y元素原子序数是2+8+1=11,则Y为Na元素;Z元素在第3周期金属元素的简单离子中半径最小,则Z是Al元素。
(1)由分析可知,T是O元素、X为N元素、Y为Na元素、Z是Al元素,故答案为:O;N;Na;Al;
(2)O原子核外有2个电子层、最外层电子数是6,原子结构示意图为![]() ,故答案为:
,故答案为:![]() ;
;
(3)同一周期元素,元素的金属性随着原子序数增大而减弱,所以Na的金属性大于Al;
金属的金属性强弱判断方法有金属与水或水置换出氢气的难易程度、金属之间的置换反应、其最高价氧化物的水化物碱性强弱,则能证明钠的金属性大于Al的有Y单质与水反应比Z单质剧烈、Y最高价氧化物的水化物的碱性比Z强,故选③④,故答案为:Na;③④;
(4)N元素的气态氢化物为氨气,最高价含氧酸为硝酸,氨气与硝酸反应生成硝酸铵,化学方程式为NH3+HNO3=NH4NO3,故答案为:NH3+HNO3=NH4NO3;
(5)O元素和氢元素以原子个数比1∶1化合形成化合物为H2O2,N元素与氢元素以原子个数比1∶2化合形成常用作火箭燃料的化合物为N2H4,N2H4与H2O2发生氧化还原反应生成氮气和水,反应的化学方程式为N2H4+2H2O2=N2+4H2O,故答案为:N2H4+2H2O2=N2+4H2O。