题目内容
【题目】X、Y、Z、M四种短周期元素,它们在周期表中位置如图所示,下列说法正确的是
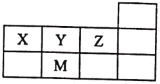
A. 原子半径:M>Z>Y>X
B. Z的气态氢化物最稳定,因其分子间存在氢键
C. 最高价氧化物对应水化物的酸性M<Z
D. 元素的非金属性:X<Y<Z
【答案】D
【解析】
由X、Y、Z、M均为短周期元素及在周期表中相对位置,可知X、Y和Z为第二周期元素, M为第三周期元素,由位置可知,X为N,Y为O,Z为F,M为S,以此来解答。
A. 电子层数越多,其原子半径越大;电子层数相同时,原子序数越小,其原子半径越大;
B. 非金属性越强,其气态氢化物的稳定性越好,这与是否含有氢键无关;
C. F元素无最高正价;
D. 在元素周期表中同一周期,元素的非金属性依次增强,同一主族,元素的非金属性依次减弱;
由上述分析可知,X为N,Y为O,Z为F,M为S,
A. 根据同一周期中,原子半径依次减小,同一主族,元素原子半径依次增大,则其原子半径由大到小排列为:M >X >Y >Z,故A项错误;
B. 元素的非金属性越强,其对应的气态氢化物的稳定性越高,则Z的气态氢化物最稳定,其分子间存在的氢键,主要影响的是物质的物理性质,跟气态氢化物的稳定性无关,故B项错误;
C. 非金属性F>O>S,但因F无正价,则无法比较Z与M的最高价氧化物对应水化物的酸性,故C项错误;
D. X、Y、Z三种元素处于同一周期,其元素的非金属性:N<O<F,即X<Y<Z,故D项正确;
答案选D。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案【题目】四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
X | Y | |
Z | W |
请回答下列问题:
(1)元素Z位于周期表中第_______周期,_______族;
(2)这些元素的氢化物中,水溶液碱性最强的是_____________(写化学式);
(3)XW2的电子式为________________________;
(4)Y的最高价氧化物的化学式为_________________。
【题目】二氯亚砜(SOCl2)是一种无色易挥发液体,剧烈水解生成两种气体,常用作脱水剂,其熔点-105℃,沸点79℃,140℃以上时易分解。
(1)用硫黄(S)、液氯和三氧化硫为原料,在一定条件合成二氯亚砜,原子利用率达100%,则三者的物质的量比为______________________。
(2)甲同学设计如图装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2(夹持及加热装置略)
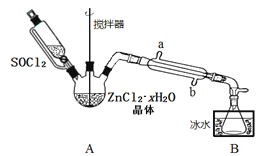
①SOCl2在该实验中的作用_________________________________;加热条件下,A装置中总的化学方程式为_________________________________。
②实验结束后,为检测ZnCl2·xH2O晶体是否完全脱水,甲同学设计实验方案如下,正确的实验顺序为___________(填序号)
a.干燥 b.洗涤; c加入足量硝酸酸化的硝酸银溶液,充分反应;
d称取蒸干后的固体m克溶于水;e.过滤; f称得固体为n克
若m/n=___________(保留小数点后两位),即可证明晶体已完全脱水。
(3)乙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丙同学认为该实验可能发生副反应使最后的产品不纯。
①可能发生的副反应的离子方程式_________________________________。
②丙同学设计了如下实验方案判断副反应的可能性:
i.取少量FeCl3·6H2O于试管中,加入足量SOCl2振荡使两种物质充分反应:
ii.往上述试管中加水溶解,取溶解后的溶液少许于两支试管,进行实验验证,完成表格内容。
供选试剂:AgNO3溶液、稀盐酸、稀HNO3、酸性KMnO4溶液、KSCN溶液、K3[Fe(CN)6]溶液、溴水)
方案 | 操作 | 现象 | 结论 |
方案一 | 往一支试管中滴加___________ | 若无明显现象 | 则发生了上述副反应 |
方案二 | 往另一支试管中滴加___________ | ___________ | 则没有发生上述副反应 |
【题目】在体积为2L的恒容密闭容器内,充入一定量的NO和O2,800°C时发生反应2NO(g)+O2(g)![]() 2NO2(g),容器中n(NO)随时间的变化如表所示:
2NO2(g),容器中n(NO)随时间的变化如表所示:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)反应在1~2s内,O2的物质的量减少__mol。该反应在第3s___(填“达到”或“未达到”)平衡状态。
(2)如图所示,表示NO2浓度变化曲线的是___(填字母)。用O2表示0~2s内该反应的平均速率v=___mol·L-1·s-1。

(3)能说明该反应已达到平衡状态的是___(填字母)。
a.容器内气体颜色不再变化
b.O2的物质的量保持不变
c.容器内混合气体的密度保持不变