题目内容
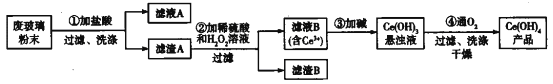
【题目】氢氧化铈[Ce(OH)4]是一种重要的稀土氢氧化物。平板电视显示屏生产过程中会产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2),某课题组以此粉末为原料回收铈,设计实验流程如下:
下列说法错误的是
A. 滤渣A中主要含有SiO2、CeO2
B. 过滤操作中用到的玻璃仪器有烧杯、漏斗、玻璃棒
C. 过程②中发生反应的离子方程式为CeO2+H2O2+3H+=Ce3++2H2O+O2↑
D. 过程④中消耗 11.2L O2(已折合成标准状况),转移电子数为2×6.02×1023
【答案】C
【解析】
该反应过程为:①CeO2、SiO2、Fe2O3等中加入稀盐酸,Fe2O3转化FeCl3存在于滤液中,滤渣为CeO2和SiO2;②加入稀硫酸和H2O2,CeO2转化为Ce3+,滤渣为SiO2;③加入碱后Ce3+转化为沉淀,④通入氧气将Ce从+3氧化为+4,得到产品。
A.CeO2、SiO2、Fe2O3等中加入稀盐酸,Fe2O3转化FeCl3存在于滤液中,滤渣为CeO2和SiO2,故A正确;B.结合过滤操作要点,实验中用到的玻璃仪器有烧杯、漏斗、玻璃棒,故B正确;C.稀硫酸、H2O2,CeO2三者反应生成转化为Ce2(SO4)3、O2和H2O,反应的离子方程式为:6H++H2O2+2CeO2=2Ce3++O2↑+4H2O,故C错误;D.过程④中消耗 11.2L O2的物质的量为0.5mol,转移电子数为0.5mol×NA=2×6.02×1023,故D正确;故答案为C。

【题目】中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯,其反应如下:2CH4(g)![]() C2H4(g) +2H2(g) △H >0
C2H4(g) +2H2(g) △H >0
化学键 | H—H | C—H | C = C | C—C |
E(kJ / mol) | a | b | c | d |
(1)已知相关化学键的键能如表,甲烷制备乙烯反应的△H =______(用含a.b.c.d的代数式表示)。
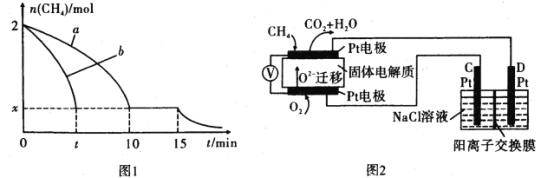
(2)T1温度时,向1L的恒容反应器中充入2 molCH4,仅发生上述反应,反应过程中0~15 min CH4的物质的量随时间变化如图1,测得10-15 min时H2的浓度为1.6molL-1
①0~10min内CH4表示的反应速率为____mol/(Lmin) o
②若图1中曲线a、曲线b分别表示在温度T1时,使用质量相同但表面积不同的催化剂时,达到平衡过程中n (CH4)的变化曲线,其中表示催化剂表面积较大的曲线是____(填“a”或 “b”)。
③15 min时,若改变外界反应条件,导致n( CH4)发生图中所示变化,则改变的条件可能是________(任答一条即可)。
(3)实验测得:v正=K正c2(CH4),v逆=K逆c(C2H4)c2(H2),其中K正、K逆为速率常数仅与温度有关,T1温度时k正与K逆的比值为____(填数值)。若将温度由T1升高到T2,则反应速率增大的倍数V正____V逆(选填“>”、“<”或“=”);判断的理由是__________
(4)科研人员设计了甲烷燃料电池并用于电解。如图2所示,电解质是掺杂了Y2O3与ZrO2的固体,可在高温下传导O2-
①C极的Pt为_____极(选填“阳”或“阴” )。
②该电池工作时负极反应方程式为_______。
③用该电池电解饱和食盐水,一段时间后收集到标况下气体总体积为112 mL,则电解后所得溶液在25℃时pH=_____(假设电解前后NaCl溶液的体积均为500 mL)。