题目内容
【题目】已知p(A)=-lgc(A)。三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是
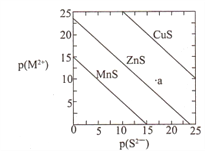
A. a点无ZnS沉淀生成
B. 可用MnS除去MnCl2溶液中混有的少量ZnCl2
C. 向CuS悬浊液中加入少量水,平衡向溶解的方向移动,c(S2-)增大
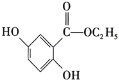
D. CuS和MnS共存的悬独液中,![]()
【答案】C
【解析】p(A)=-lgc(A),则c(A)=10-p(A)mol/L,故p(A)越大,c(A)越小 。所以平衡曲线右上方为不饱和溶液,平衡曲线左下方为过饱和溶液。A、a点不饱和,没有ZnS沉淀析出,故A正确;B、MnS的溶解度大于ZnS,向MnCl2溶液中加入MnS固体,可以促使平衡MnS(s)+Zn2+ ZnS(s)+Mn2+向右移动,即MnS转化为更难溶的ZnS,达到除去Zn2+的目的,故B正确;C、
向CuS悬浊液中加入少量水,平衡向溶解的方向移动,由于悬浊液中存在CuS固体,溶液依然是饱和的,所以c(S2-)不变,故C错误;D、当p(S2-)=0,p(Mn2+)=15,即c(S2-)=1mol/L时,c(Mn2+)=10-15mol/L,Ksp(MnS)= c(Mn2+)×c(S2-)=10-15;当p(S2-)=25,p(Zn2+)=25,即c(S2-)=10-25mol/L,c(Zn2+)=10-10mol/L,Ksp(ZnS)= c(Zn2+)×c(S2-)=10-35;CuS和MnS共存的悬独液中, ![]() =10-20,故D正确。故选C。
=10-20,故D正确。故选C。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案【题目】为检验溶液中是否含有Cl-,某同学采用向溶液中先加HNO3,再加AgNO3,溶液的实验方案,若有白色沉淀生成,则证明有Cl-。对此结论,有人提出了质疑,设计了如下探究性实验。
实验一:向Na2SO4溶液中滴加AgNO3溶液
编号 | Na2SO4溶液 | AgNO3溶液 | 现象 | ||
体积/mL | 浓度/(mol·L-1) | 体积/滴 | 浓度/(mol·L-1) | ||
① | 1 | l | 3 | 2 | 出现大量白色沉淀 |
② | 1 | 1 | 3 | 0.5 | 出现少量白色沉淀 |
③ | 1 | 1 | 3 | 0.1 | 有些许浑浊 |
④ | 1 | 1 | 3 | 0.0l | 无明显变化 |
(1)实验一中产生沉淀的离子方程式为______。
(2)学生设计了如下表格,对实验一内容进行理论计算,请帮他完成表格。(表中不要留空格)。
[25℃时Ksp(Ag2SO4)=1.2×10-5,Ksp(AgCl)=1.8×10-10]
编号 | AgNO3浓度/(mol·L-1) | 稀释后Ag+浓度/(mol·L-1) | 混合液中SO42-的最小理论检出浓度/(mol·L-1) |
① | 2 | 0.2 | 0.0003 |
② | 0.5 | _______ | 0.0048 |
③ | 0.1 | 0.0l | 0.12 |
④ | _______ | 0.001 | _________ |
若向lmL某溶液中加入3滴0.1mol/LAgNO3溶液,分析上面数据,判断下列说法正确的是__ (填字母序号)。
A.混合液中c(SO42-)=0.1mol/L时不会产生Ag2SO4沉淀
B.混合液中c(SO42-)=1mol/L时不会产生Ag2SO4沉淀
C.无论SO42-浓度大小都会产生Ag2SO4沉淀
D.若使用0.01 mol/LAgNO3溶液,可基本排除SO42-对Cl-检验构成的干扰
(3)将实验一中编号③中的理论计算结果与现象对照,发现理论上大部分Ag+应该形成沉淀,这与“有些许浑浊”的现象相矛盾。为探究真相,在实验一的基础上继续设计了以下实验。
实验二:
编号 | AgNO3溶液 浓度/(mol·L-1) | 现象 | 向沉淀中滴加硝酸后的现象 |
① | 2 | 出现大量白色沉淀 | 滴加稀硝酸,沉淀大量溶解;改加浓硝酸,沉淀较快消失 |
② | 0.5 | 出现少量白色沉淀 | 滴加稀硝酸,沉淀基本消失 |
对于Ag2SO4溶于硝酸的原因提出了如下假设,请完成假设一。(已知:H2SO4=H++HSO4-、HSO4-![]() H++SO42-;假设二可能的原因是NO3-与Ag+形成配位化合物)
H++SO42-;假设二可能的原因是NO3-与Ag+形成配位化合物)
假设一:_____________。
假设二:NO3-对Ag2SO4溶解起作用。
(4)从下列限选试剂中选择适当试剂并设计实验方案,分别验证假设一和假设二是否成立。请写出实验步骤和结论。(限选试剂:Ag2SO4固体、浓HNO3、NaNO3饱和溶液、CaSO4固体)
________________
(5)通过(4)的实验,若证实假设一成立,请用平衡理论解释Ag2SO4溶解的原因_________
【题目】“中和滴定”原理在实际生产生活中应用广泛。用I2O5可定量测定CO的含量,该反应原理为5CO+I2O5![]() 5CO2+I2。其实验步骤如下:
5CO2+I2。其实验步骤如下:
①取250 mL(标准状况)含有CO的某气体样品通过盛有足量I2O5的干燥管中在170 ℃下充分反应;
②用水一乙醇液充分溶解产物I2,配制100 mL溶液;
③量取步骤②中溶液25.00 mL于锥形瓶中,然后用0.01 mol·L-1的Na2S2O3标准溶液滴定。消耗标准Na2S2O3溶液的体积如表所示。
第一次 | 第二次 | 第三次 | |
滴定前读数/mL | 2.10 | 2.50 | 1.40 |
滴定后读数/mL | 22.00 | 22.50 | 21.50 |
(1)步骤②中配制100 mL待测溶液需要用到的玻璃仪器的名称是烧杯、量筒、玻璃棒、胶头滴管和____________________。
(2)Na2S2O3标准液应装在__________(填字母)中。

(3)指示剂应选用__________,判断达到滴定终点的现象是____________________________________。
(4)气体样品中CO的体积分数为__________(已知:气体样品中其他成分不与I2O5反应:2Na2S2O3+I2=2NaI+Na2S4O6)
(5)下列操作会造成所测CO的体积分数偏大的是__________(填字母)。
a.滴定终点俯视读数
b.锥形瓶用待测溶液润洗
c.滴定前有气泡,滴定后没有气泡
d.配制100 mL待测溶液时,有少量溅出
【题目】某化学课外小组的同学通过实验探究认识化学反应速率和化学反应限度。
(1)实验一:探究温度和浓度对反应速率的影响
实验原理及方案:在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生反应生成碘,反应原理是2IO3-+5SO32-+2H+===I2+5SO42-+H2O,生成的碘可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率。
实验序号 | 0.01 mol·L-1 KIO3酸性溶液(含淀粉)的体积/mL | 0.01 mol·L-1 Na2SO3溶液的体积/mL | 水的体积/mL | 实验温度/℃ | 出现蓝色的时间/s |
① | 5 | 5 | V1 | 0 | |
② | 5 | 5 | 40 | 25 | |
③ | 5 | V2 | 35 | 25 |
则V1=________ mL,V2=________ mL。
(2)实验二:探究KI和FeCl3混合时生成KCl、I2和FeCl2的反应存在一定的限度。实验步骤:
ⅰ.向5 mL 0.1 mol·L-1 KI溶液中滴加5~6滴0.1 mol·L-1 FeCl3溶液,充分反应后,将所得溶液分成甲、乙、丙三等份;
ⅱ.向甲中滴加CCl4,充分振荡;
ⅲ.向乙中滴加试剂X。
①将KI和FeCl3反应的离子方程式补充完整:____I-+____Fe3+ ![]() ____I2+____Fe2+。
____I2+____Fe2+。
②步骤ⅲ中,试剂X是_________________。
③步骤ⅱ和ⅲ中的实验现象说明KI和FeCl3混合时生成KCl、I2和FeCl2的反应存在一定的限度,该实验现象是________________________________。