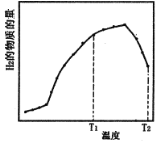
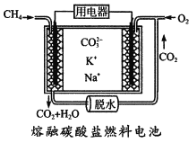
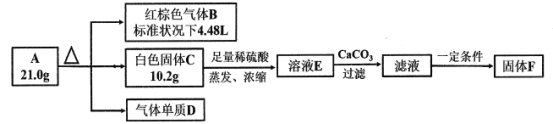
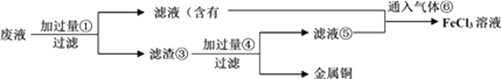
题目内容
【题目】镍及其化合物是重要的合金材料和催化剂。请回答下列问题:
(1)基态镍原子的价电子排布式为___________,排布时最高能层的电子所占的原子轨道有__________个伸展方向。
(2)镍能形成多种配合物如正四面体形的Ni(CO)4 和正方形的[Ni(CN)4]2-、正八面体形的[Ni(NH3)6]2+等。下列说法不正确的有_________。
A.CO与CN-互为等电子体,其中CO分子内σ键和π键个数之比为1:2
B.NH3的空间构型为平面三角形
C.Ni2+在形成配合物时,其配位数可能为是4或6
D.Ni(CO)4中,镍元素是sp3杂化
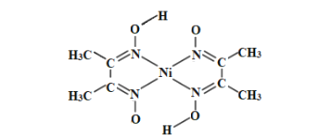
(3)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用“”表示出氢键。_____
(4)NiO的晶体结构类型与氯化钠的相同,相关离子半径如下表:
![]()
NiO晶胞中Ni2+的配位数为_______,NiO熔点比NaCl高的原因是_______________________。
(5)研究发现镧镍合金LaNix是一种良好的储氢材料。合金LaNix晶体属六方晶系如图a所示,其晶胞如图a中实线所示,如图b所示(其中小圆圈代表La,小黑点代表Ni)。储氢位置有两种,分别是八面体空隙(“![]() ”)和四面体空隙(“
”)和四面体空隙(“![]() ”),见图c、d,这些就是氢原子存储处。
”),见图c、d,这些就是氢原子存储处。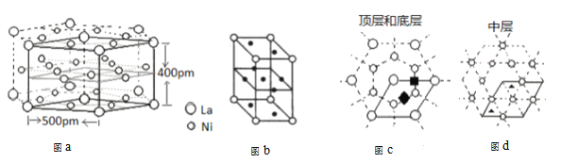
①LaNix合金中x的值为_____;
②LaNix晶胞的密度是________g/cm-3(阿伏伽德罗常数用NA表示,LaNix的摩尔质量用M表示 )
③晶胞中和“![]() ”同类的八面体空隙有______个。
”同类的八面体空隙有______个。
【答案】3d84s2 1 B  6 离子半径越小,离子所带电荷越多,键长越短,键能越大,熔点越高 5
6 离子半径越小,离子所带电荷越多,键长越短,键能越大,熔点越高 5 ![]() 3
3
【解析】
(1)Ni元素原子序数是28,其3d、4s电子为其价电子,3d、4s能级上电子数分别是8、2,据此书写其价电子排布式,找到最高能层,为N层,能级为4s,判断它的空间伸展方向;
(2)A.CO与CN-互为等电子体,则一氧化碳中含有碳氧三键,其中σ键个数为1;π键个数为2;故σ键和π键个数之比为1:2;
B.NH3的中心原子为N,价层电子岁数为4对,有一对孤对电子,sp3杂化,空间构型为三角锥形;
C.根据题干信息,镍能形成多种配合物如正四面体形的Ni(CO)4 和正方形的[Ni(CN)4]2-、正八面体形的[Ni(NH3)6]2+,因此Ni2+在形成配合物时,其配位数可能为是4或6;
D.Ni(CO)4中,镍元素成键电子对数为4,孤电子对数为0,则价电子对数为4;
(3)中心原子提供空轨道配体提供孤电子对形成配位键;氢键存在于已经与N、O、F等电负性很大的原子形成共价键的H与另外的N、O、F等电负性很大的原子之间,则氢键表示为  ;
;
(4)因为NiO的晶体结构类型均与氯化钠的相同,而氯化钠中阴阳离子的配位数均为6,所以NiO晶胞中Ni和O的配位数也均为6;根据表格数据,氧离子和镍离子的半径小于钠离子和氯离子,则NiO的键长小于NaCl,离子半径越小,键长越短,键能越大,熔点越高,所以氧化镍熔点高于氯化钠熔点;
(5) ①由图b可知,La的个数为8×![]() =1,Ni的个数为8×
=1,Ni的个数为8×![]() +1=5,La与Ni的个数比1:5,则x=5;
+1=5,La与Ni的个数比1:5,则x=5;
②由图a可得晶胞的体积V=5×10-8cm×5×10-8cm×4×10-8cm=1×10-21cm3,密度= ![]() 进行计算;
进行计算;
③六个球形成的空隙为八面体空隙,显然图c中的八面体空隙都是由2个La原子和4个Ni原子所形成,这样的八面体空隙位于晶胞的,上底和下底的棱边和面心处,共有8×![]() +2×
+2×![]() =3个;
=3个;
(1)Ni元素原子序数是28,其3d、4s电子为其价电子,3d、4s能级上电子数分别是8、2,其价电子排布式为3d84s2,最高能层的电子为N,分别占据的原子轨道为4s,原子轨道为球形,所以有一种空间伸展方向;
答案为:3d84s2;1;
(2)A.CO与CN-互为等电子体,则一氧化碳中含有碳氧三键,其中σ键个数为1;π键个数为2;故σ键和π键个数之比为1:2,故A正确;
B.NH3的中心原子为N,价层电子岁数为4对,有一对孤对电子,sp3杂化,空间构型为三角锥形,故B错误;
C.根据题干信息,镍能形成多种配合物如正四面体形的Ni(CO)4 和正方形的[Ni(CN)4]2-、正八面体形的[Ni(NH3)6]2+,因此Ni2+在形成配合物时,其配位数可能为是4或6,故C正确;
D.Ni(CO)4中,镍元素成键电子对数为4,孤电子对数为0,则价电子对数为4,是sp3杂化,故D正确;
答案选B。
(3)中心原子提供空轨道配体提供孤电子对形成配位键;氢键存在于已经与N、O、F等电负性很大的原子形成共价键的H与另外的N、O/span>、F等电负性很大的原子之间,则氢键表示为 ,
,
故答案为: ;
;
(4)因为NiO的晶体结构类型均与氯化钠的相同,而氯化钠中阴阳离子的配位数均为6,所以NiO晶胞中Ni和O的配位数也均为6;根据表格数据,氧离子和镍离子的半径小于钠离子和氯离子,则NiO的键长小于NaCl,二者都属于离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷越多,离子半径越小,离子键越强,熔点越高,所以氧化镍熔点高于氯化钠熔点,
答案为:6;离子半径越小,离子所带电荷越多,键长越短,键能越大,熔点越高;
(5) ①由图b可知,La的个数为8×![]() =1,Ni的个数为8×
=1,Ni的个数为8×![]() +1=5,La与Ni的个数比1:5,则x=5;
+1=5,La与Ni的个数比1:5,则x=5;
答案为:5;
②由图a可得晶胞的体积V=5×10-8cm×5×10-8cm×4×10-8cm=1×10-21cm3,密度= ![]() =
=![]() g/cm-3,
g/cm-3,
答案为:![]() ;
;
③六个球形成的空隙为八面体空隙,显然图c中的八面体空隙都是由2个La原子和4个Ni原子所形成,这样的八面体空隙位于晶胞的,上底和下底的棱边和面心处,共有8×![]() +2×
+2×![]() =3个,
=3个,
答案为:3。