题目内容
【题目】探究化合物A(仅含三种短周期元素)的组成和性质,设计并完成如下实验:
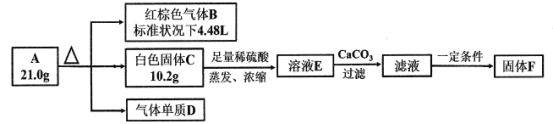
已知:白色固体C既能与强酸反应,也能与强碱反应。
请回答:
(1)写出A受热分解的化学方程式为___________________________________________。
(2)请设计实验方案检验溶液E中所含的阳离子_________________________________。
(3)若固体F中金属元素的百分含量为19.29%,硫为22.86%,氧为57.14%,且300 g/mol<MF<450 g/mol,则F的化学式为____________。
【答案】![]() 取玻璃棒蘸取少量溶液于pH试纸上,成红色,说明有氢离子,另取少量溶液与试管中,加入NaOH溶液,先产生沉淀,后沉淀消失,说明溶液中存在铝离子
取玻璃棒蘸取少量溶液于pH试纸上,成红色,说明有氢离子,另取少量溶液与试管中,加入NaOH溶液,先产生沉淀,后沉淀消失,说明溶液中存在铝离子 ![]()
【解析】
红棕色气体B为二氧化氮,生成的物质的量为0.2mol,白色固体C既能与强酸反应,也能与强碱反应,说明其为氧化铝或氢氧化铝,由于A仅含有三种短周期元素,故C为氧化铝,其物质的量为0.1mol,则气体单质D为氧气,生成的质量为![]() ,则其物质的量为0.05mol,故A的化学式为
,则其物质的量为0.05mol,故A的化学式为![]() 。
。
(1)通过分析可写出A受热分解的化学方程式为![]() ;
;
(2)E中的阳离子为氢离子和铝离子,故可设计两组实验,取玻璃棒蘸取少量溶液于pH试纸上,成红色,说明有氢离子,另取少量溶液与试管中,加入NaOH溶液,先产生沉淀,后沉淀消失,说明溶液中存在铝离子;
(3)根据原子守恒,可知,F中Al元素的质量为![]() ,故F的质量为5.4g÷19.29%=28g,故可算出S的质量为6.40g,O的质量为16.00g,剩余为H的质量,因为300 g/mol<MF<450 g/mol,可得出其化学式为
,故F的质量为5.4g÷19.29%=28g,故可算出S的质量为6.40g,O的质量为16.00g,剩余为H的质量,因为300 g/mol<MF<450 g/mol,可得出其化学式为![]() 。
。

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目