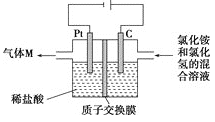
题目内容
【题目】在一定条件下,利用 CO2 合成 CH3OH 的反应如下:CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g)△H1,研究发现,反应过程中会有副反应:CO2(g) + H2(g)
CH3OH(g) + H2O(g)△H1,研究发现,反应过程中会有副反应:CO2(g) + H2(g)![]() CO(g) + H2O(g) △H2。温度对 CH3OH、CO 的产率影响如图所示。下列说法中,不正确的是
CO(g) + H2O(g) △H2。温度对 CH3OH、CO 的产率影响如图所示。下列说法中,不正确的是
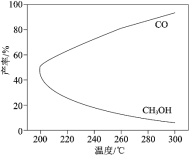
A.△H1 < 0,△H2 > 0
B.增大压强可以缩短合成反应达到平衡所需的时间
C.生产过程中,温度越高越有利于提高 CH3OH 的产率
D.合成 CH3OH 反应的平衡常数表达式是K=![]()
【答案】C
【解析】
A.从图中可以看出,CH3OH的产率随温度升高而减小,说明合成CH3OH的反应为放热反应,故△H1< 0,CO的产率随温度升高而增大,副反应为吸热反应,故△H2> 0,故A正确;
B.增大压强,物质的浓度增大,反应速率加快,故可以缩短合成反应达到平衡所需的时间,故B正确;
C.生产过程中,温度越高,合成CH3OH的反应平衡逆向移动,导致产率减小,同时副反应正向移动,故温度越高,越不利于提高CH3OH的产率,故C错误;
D.根据合成CH3OH反应方程式可知,由于H2O是气体,故该反应的平衡常数表达式是K=![]() ,故D正确;
,故D正确;
故答案为C。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】汽车发动机中生成 NO 的反应为:N2(g) + O2(g)![]() 2NO(g),t℃时,K= 0.09。在 t℃下甲、乙、丙三个恒容密闭容器中,投入 N2(g)和 O2(g)模拟反应,起始浓度如下表所示。
2NO(g),t℃时,K= 0.09。在 t℃下甲、乙、丙三个恒容密闭容器中,投入 N2(g)和 O2(g)模拟反应,起始浓度如下表所示。
起始浓度 | 甲 | 乙 | 丙 |
c(N2)/mol·L-1 | 0.46 | 0.46 | 0.92 |
c(O2)/mol·L-1 | 0.46 | 0.23 | 0.92 |
下列判断不正确的是
A.起始时,反应速率:丙>甲>乙B.平衡时,N2 的转化率:甲>乙
C.平衡时,c(NO):甲=丙>乙D.平衡时,甲中 c(N2)= 0.4mol·L-1
【题目】某实验小组对FeCl3分别与Na2SO3、NaHSO3的反应进行探究。
(甲同学的实验)
装置 | 编号 | 试剂X | 实验现象 |
| I | Na2SO3溶液(pH≈9) | 闭合开关后灵敏电流计指针发生偏转 |
II | NaHSO3溶液(pH≈5) | 闭合开关后灵敏电流计指针未发生偏转 |
(1)配制FeCl3溶液时,先将FeCl3溶于浓盐酸,再稀释至指定浓度。结合化学用语说明浓盐酸的作用:。
(2)甲同学探究实验I的电极产物______________。
①取少量Na2SO3溶液电极附近的混合液,加入______________,产生白色沉淀,证明产生了![]() 。
。
②该同学又设计实验探究另一电极的产物,其实验方案为______________。
(3)实验I中负极的电极反应式为______________。
(乙同学的实验)
乙同学进一步探究FeCl3溶液与NaHSO3溶液能否发生反应,设计、完成实验并记录如下:
装置 | 编号 | 反应时间 | 实验现象 |
| III | 0~1 min | 产生红色沉淀,有刺激性气味气体逸出 |
1~30 min | 沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色 | ||
30 min后 | 与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色 |
(4)乙同学认为刺激性气味气体的产生原因有两种可能,用离子方程式表示②的可能原因。
① Fe3++3![]()
![]() Fe(OH)3 +3SO2;②______________。
Fe(OH)3 +3SO2;②______________。
(5)查阅资料:溶液中Fe3+、![]() 、OH-三种微粒会形成红色配合物并存在如下转化:
、OH-三种微粒会形成红色配合物并存在如下转化:
![]()
从反应速率和化学平衡两个角度解释1~30 min的实验现象:______________。
(6)解释30 min后上层溶液又变为浅红色的可能原因:______________。
(实验反思)
(7)分别对比I和II、II和III,FeCl3能否与Na2SO3或NaHSO3发生氧化还原反应和有关(写出两条)______________。