题目内容
【题目】已知: (1)Fe2O3(s)+![]() C(s)=
C(s)=![]() CO2(g)+2Fe(s),ΔH=+234.1kJmol-1
CO2(g)+2Fe(s),ΔH=+234.1kJmol-1
![]() 则
则![]() 的ΔH是( )
的ΔH是( )
A.-824.4 kJmol-1B.-627.6kJmol-1C.-744.7kJmol-1D.-169.4kJmol-1
【答案】A
【解析】
已知:(1)2Fe(s)+![]() CO2(g)=Fe2O3(s)+
CO2(g)=Fe2O3(s)+![]() C(s)△H=-234.1kJmol-1(2)C(s)+O2(g)=CO2(g)△H=-393.5kJmol-1,由盖斯定律(2)×
C(s)△H=-234.1kJmol-1(2)C(s)+O2(g)=CO2(g)△H=-393.5kJmol-1,由盖斯定律(2)×![]() +(1),得:2Fe(s)+
+(1),得:2Fe(s)+![]() O2(g)=Fe2O3(s)△H=(-393.5kJmol-1)×
O2(g)=Fe2O3(s)△H=(-393.5kJmol-1)×![]() +(-234.1kJmol-1)=-824.4kJmol-1,可知:2Fe(s)+
+(-234.1kJmol-1)=-824.4kJmol-1,可知:2Fe(s)+![]() O2(g)=Fe2O3(s)△H=-824.4kJmol-1,故答案为A。
O2(g)=Fe2O3(s)△H=-824.4kJmol-1,故答案为A。

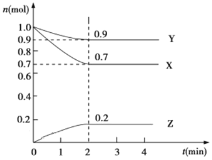
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了酸性高锰酸钾与草酸的反应,记录以下实验数据(已知![]() 为阿伏伽德罗常数的值):
为阿伏伽德罗常数的值):
试管中所加试剂及其用量/mL | 溶液退至无色所需时间/min | |||||
实验编号 | 实验温度/℃ | 0.6 mol/LH2C2O4溶液 | H2O | 3 mol/LH2SO4溶液 | 0.05 mol/LKMnO4溶液 | |
① | 25 | 3.0 | v1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | v2 | 2.0 | 3.0 | 1.0 |
(1)请写出该反应的离子方程式:___,当该反应以实验①中数据反应完全时转移电子数为_____![]() 。
。
(2)实验①②是探究浓度对反应速率的影响,实验②③时探究温度对反应速率的影响,则表中V1=_______,V2=__________。
(3)根据实验①、②的数据,可以得到的结论是____。
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。

该小组同学根据上述信息提出了新的假设,并设计一下实验方案继续进行实验探究。
实验编号 | 实验温度/℃ | 试管中所加试剂及其用量/ml | 再加入某种固体 | 溶液退至无色所需时间/min | |||
0.6 mol/LH2C2O4溶液 | H2O | 3 mol/LH2SO4溶液 | 0.05 mol/L KMnO4 溶液 | ||||
④ | 25 | 3.0 | 2.0 | 2.0 | 3.0 | MnSO4 | t |
①该小组同学提出的新假设是__________。
②若该小组同学提出的假设成立,应观察到__________(填实验现象)。