题目内容
14.下表是元素周期表示意图的一部分,根据A~I在元素周期表中的位置,用元素符号或化学式回答下列问题:| 周期/族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)表中元素最高价氧化物的水化物的碱性最强的化合物是NaOH,酸性最强的化合物是HClO4,呈两性的化合物是Al(OH)3.
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的是HF.
分析 由元素在周期表中的位置可知,A为H,B为Na,C为Al,D为C,E为N,F为P,G为F,H为Cl,I为Ne.
(1)稀有气体原子最外层为稳定结构,化学性质最不活泼;氟元素只有负化合价而无正化合价;同周期自左而右元素金属性减弱、非金属增强,同主族自上而下元素金属性增强、非金属性减弱;
(2)元素金属性越强,最高价氧化物对应水化物的碱性越强,氟元素没有最高价含氧酸,上述元素最高价氧化物对应水化物中,高氯酸的酸性最强;氢氧化铝属于两性氢氧化物;
(3)元素非金属性越强,对氢化物越稳定.
解答 解:由元素在周期表中的位置可知,A为H,B为Na,C为Al,D为C,E为N,F为P,G为F,H为Cl,I为Ne.
(1)稀有气体Ne原子最外层为稳定结构,化学性质最不活泼;氟元素只有负化合价而无正化合价;同周期自左而右元素金属性减弱、非金属增强,同主族自上而下元素金属性增强、非金属性减弱,故F元素非金属性最强、Na的金属性最强,故法案为:Ne;F;F;Na;
(2)上述元素中Na的金属性最强,故NaOH的碱性最强,氟元素没有最高价含氧酸,上述元素最高价氧化物对应水化物中,HClO4的酸性最强;Al(OH)3属于两性氢氧化物,故答案为:NaOH;HClO4;Al(OH)3;
(3)D、E、F、G、H中F元素非金属性最强,故HF最稳定,故答案为:HF.
点评 本题考查元素周期表和元素周期律,难度不大,侧重对元素周期律的考查,有利于基础知识的巩固.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
7.常温下,下列各组粒子在指定溶液中能大量共存的是( )
| A. | 含大量Fe3+的溶液中:NH4+、Mg2+、Cl-、HSO3- | |
| B. | 加入Al有H2生成的溶液中:Na+、NH4+、Cl-、NO3- | |
| C. | NaOH溶液中:K+、Na+、AlO2-、CO32- | |
| D. | NaHCO3溶液中:K+、Al3+、Cl-、SO42- |
8.现有如图4个装置图,则以下说法中正确的是( )
| A. | 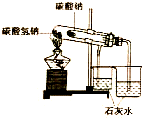 装置可用于比较NaHCO3和Na2CO3的稳定性 | |
| B. | 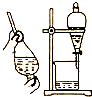 用酒精萃取溴水中的溴可选择装置 | |
| C. |  如图装置进行实验可看到酸性KMnO4溶液褪色 | |
| D. | 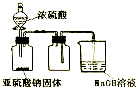 如图装置可用于实验室制取并收集少量SO2 |
2.已知:
2H2(g)+O2(g)=2H2O(l)△H=-572kJ•mol-1
H2(g)+0.5O2(g)=H2O(g)△H=-242kJ•mol-1
现有1mol液态水,蒸发时吸收的热量是( )
2H2(g)+O2(g)=2H2O(l)△H=-572kJ•mol-1
H2(g)+0.5O2(g)=H2O(g)△H=-242kJ•mol-1
现有1mol液态水,蒸发时吸收的热量是( )
| A. | 2.44 kJ | B. | 44 kJ | C. | 88 kJ | D. | 330 kJ |
19.下列解释事实的化学方程式或离子方程式,不正确的是( )
| A. | 在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+H2O2+2H+=I2+O2↑+2H2O | |
| B. | 自然界中正常的雨水呈酸性:H2O+CO2?H2CO3?H++HCO3- | |
| C. | 将1mol/L NaAlO2溶液和1mol/L的H2SO4溶液等体积均匀混合:3AlO2-+6H+=2Al(OH)3↓+Al3+ | |
| D. | 向明矾溶液中滴加氢氧化钡溶液至SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O |
6.下列实验操作能达到实验目的是( )
| 编号 | 实验 | 操作 |
| A | 测定次氯酸钠的pH | 用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,变色后,与标准比色卡对比 |
| B | 配制一定浓度的氯化钾溶液1000mL | 准确称取氯化钾固体,放入到1000mL的容量瓶中,加水溶解,振荡摇匀,定容 |
| C | 排除碱式滴定管尖嘴部分的气泡 | 将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴快速流出 |
| D | 取出分液漏斗中所需的上层液体 | 将下层液体从分液漏斗下端管口放出后,关闭活塞,换一个接收容器,从分液漏斗下端管口继续放出下层液体 |
| A. | A | B. | B | C. | C | D. | D |
3.下列说法错误的是( )
| A. | s轨道呈圆形,p轨道呈哑铃形 | |
| B. | Cu元素在元素周期表的ds区 | |
| C. | 1.5g CH3+中含有的电子数为0.8NA | |
| D. | DNA中的碱基互补配对是通过氢键来实现的 |
4.等质量的下列物质中,含分子个数最多的是( )
| A. | Na2O2 | B. | CO2 | C. | H2 | D. | Cl2 |
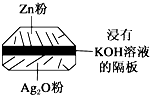 (1)铅蓄电池是典型的可充型电池,电池总反应式为:Pb+PbO2+4H++2$S{O}_{4}^{2-}$$?_{充电}^{放电}$2PbSO4+2H2O.请回答下列问题(不考虑氢、氧的氧化还原):
(1)铅蓄电池是典型的可充型电池,电池总反应式为:Pb+PbO2+4H++2$S{O}_{4}^{2-}$$?_{充电}^{放电}$2PbSO4+2H2O.请回答下列问题(不考虑氢、氧的氧化还原):