题目内容
9.几种短周期元素的原子半径及主要化合价如下表:| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | X、Y元素的最高价氧化物对应的水化物的碱性:Y比X弱 | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于浓氨水 | |
| D. | 一定条件下,X单质可以将W单质从其氢化物中置换出来 |
分析 W化合价为-2价,处于ⅥA则,Z元素化合价为+5、+3、-3,Z处于ⅤA族,X化合价为+2价,处于ⅡA族,Y的化合价为+3价,处于ⅢA族,X、Y原子半径相近,W、Z原子半径相近,且于X、Y的原子半径与W、Z原子半径相差很大,则X、Y应在第三周期,Z、W应在第二周期,可推知X为Mg、Y为Al、Z为N、W为O,据此解答.
解答 解:W化合价为-2价,处于ⅥA则,Z元素化合价为+5、+3、-3,Z处于ⅤA族,X化合价为+2价,处于ⅡA族,Y的化合价为+3价,处于ⅢA族,X、Y原子半径相近,W、Z原子半径相近,且于X、Y的原子半径与W、Z原子半径相差很大,则X、Y应在第三周期,Z、W应在第二周期,可推知X为Mg、Y为Al、Z为N、W为O.
A.金属性Mg>Al,故碱性Mg(OH)2>Al(OH)3,故A正确;
B.在放电条件下氮气与氧气可以化合生成NO,不能直接生成NO2,故B错误;
C.Y的最高价氧化物的水化物是氢氧化铝,不溶于弱碱氨水,故C错误;
D.一定件下,Mg与水反应生成氢氧化镁与氢气,不能置换出氧气,故D错误,
故选A.
点评 本题考查元素位置结构和性质的关系及应用,难度中等,从原子半径和元素的化合价入手寻求突破,正确把握元素化合价、原子半径与元素性质的关系是解答该题的关键.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
17.下列实验或生产过程中发生的变化是物理变化的是( )
①在鸡蛋白溶液中加入(NH4)2SO4后形成沉淀;②用渗析的方法除去混在Fe(OH)3胶体中的FeCl3;③NO2经加压凝聚成无色的液体;④溴水滴入植物油中振荡褪色;⑤水泥、沙子和水混合后硬化;⑥照相底片感光.
①在鸡蛋白溶液中加入(NH4)2SO4后形成沉淀;②用渗析的方法除去混在Fe(OH)3胶体中的FeCl3;③NO2经加压凝聚成无色的液体;④溴水滴入植物油中振荡褪色;⑤水泥、沙子和水混合后硬化;⑥照相底片感光.
| A. | ①②③ | B. | ②④⑥ | C. | ①② | D. | ③⑤ |
4.美国 lawrece liremore 国家实验室(LINL)的V•Lota•C•S•You和H•Cynn成功地在高压下将CO2转化为具有类似SiO2结构的晶体,下列关于CO2的原子晶体的说法正确的是( )
| A. | CO2的原子晶体和分子晶体互为同分异构体 | |
| B. | 在一定的条件下,转化为分子晶体是物理变化 | |
| C. | CO2的原子晶体和分子晶体具有相同的物理性质和化学性质 | |
| D. | 在CO2的原子晶体中,每一个C原子周围结合4个O原子,每一个O原子跟两个碳原子结合 |
1.下列化合物中,只存在共价键的是( )
| A. | NaOH | B. | H2O | C. | KCl | D. | CaO |
18.把CO2通入下列溶液后变浑浊的是( )
| A. | 醋酸钠溶液 | B. | 苯酚钠溶液 | ||
| C. | 氯化钙溶液 | D. | 饱和的碳酸钠溶液 |
19.下列有关说法或操作中,属于正确的有( )
| A. | 用丁达尔效应可区别NaCl溶液和Fe(OH)3胶体 | |
| B. | 用洁净的铂丝蘸取溶液在火焰上灼烧,产生黄色的火焰,则原溶液中一定不含有K+ | |
| C. | 用25 mL量筒准确量取4.0 mol/L的盐酸5.62 mL | |
| D. | 配制1.2mol/LNaOH溶液时,若容量瓶中原来有少量蒸馏水,则使实验结果偏低 |

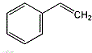 .
. +NaOH $→_{△}^{水}$
+NaOH $→_{△}^{水}$ +NaBr.
+NaBr. .
.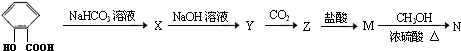
 Y
Y M
M N
N
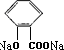 +CO2+H2O→
+CO2+H2O→ +NaHCO3.
+NaHCO3.