题目内容
10.NA代表阿伏加德罗常数的数值,下列说法正确的是( )| A. | 1 mol Cl2参加的任何反应,反应过程中转移电子数都是2NA | |
| B. | 标准状况下,22.4mL水中含有的分子数目约为1.24NA | |
| C. | 常温常压下,17g甲基(-14CH3)所含的中子数为9NA | |
| D. | 0.1 mol Na2O2中含有的离子数为0.4 NA |
分析 A、氯气与氢氧化钠溶液的反应生成氯化钠、次氯酸钠和水,1mol氯气完全反应转移了1mol电子;
B、标况下,水为液态,应根据质量求算其物质的量和分子个数;
C、求出甲基的物质的量,然后根据1mol甲基(-14CH3)含8mol中子来分析;
D、1molNa2O2中含2mol钠离子和1mol过氧根构成.
解答 解:A.1molCl2参加的反应,如果与金属反应,1mol氯气得到2mol电子,但是氯气与氢氧化钠溶液的反应中,氯气既是氧化剂也是还原剂,1mol氯气完全反应转移了1mol电子,所以1mol氯气反应转移电子数不一定为2NA,故A错误;
B、标况下,水为液态,故不能根据气体摩尔体积来计算,但由于水的密度为1g/mL,故22.4mL的水的质量为22.4g,则其含有的分子个数N=$\frac{m}{M}{N}_{A}$=$\frac{22.4g}{18g/mol}{N}_{A}$=1.24NA个,故B正确;
C、17g甲基的物质的量为n=$\frac{17g}{17g/mol}$=1mol,而1mol甲基(-14CH3)含8mol中子,即8NA个,故C错误;
D、1molNa2O2中含2mol钠离子和1mol过氧根构成,故0.1mol过氧化钠中含0.3mol离子即0.3NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
20.已知:①Q、M、R、X、Y、Z为元素周期表中前四周期六种元素;②Q、M、X、Y为同周期原子序数依次增大的连续元素;③R、M、Z为同主族元素,下列判断正确的是( )
| A. | 这六种元素可能全部是主族元素 | B. | Y一定是主族元素 | ||
| C. | M与Z的原子核外电子数相差18 | D. | Q的最高价氧化物一定能溶于强碱 |
1.氰酸铵(NH4OCN)与尿酸[CO(NH2)2]( )
| A. | 都是共价化合物 | B. | 都是离子化合物 | C. | 互为同素异形体 | D. | 互为同分异构体 |
18.下列有关金属的工业制法中,正确的是( )
| A. | 制铁:以铁矿石为原料,CO还原得铁 | |
| B. | 制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液 | |
| C. | 制镁:用海水为原料,经一系列过程制得氧化镁固体,H2还原得镁 | |
| D. | 制铝:从铝土矿中获得氧化铝再得到氯化铝固体,电解熔融的氯化铝得到铝 |
5.以下物质间的每步转化同一一步反应不能实现的是( )
| A. | NaHCO3→CO2→Na2CO3 | B. | Fe→FeCl2→FeCl3 | ||
| C. | SiO2→Na2SiO3→H2SiO3 | D. | Al2O3→A1(OH)3→NaAlO2 |
2.下列解释事实的反应方程式不正确的是( )
| A. | 碳酸钠溶液显碱性:CO32-+H2O?HCO3-+OH- | |
| B. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-═Fe3+ | |
| C. | 以Na2S为沉淀剂,除去溶液中的Cu2+:Cu2++S2-═CuS↓ | |
| D. | 向KI溶液中滴加稀硫酸和淀粉溶液,放置在空气中变蓝:4H++4I-+O2═2I2+2H2O |
9.三种元素的粒子Xm-、Yn+、Zp+都有相同的电子层结构,已知n>p,则它们核内质子数的关系为( )
| A. | X=Y=Z | B. | Y>Z>X | C. | X>Z>Y | D. | Z=Y>X |
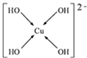 ;N3-和CO2是等电子体,则N3-的结构式为[N=N=N]-.
;N3-和CO2是等电子体,则N3-的结构式为[N=N=N]-.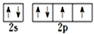 .
. 氯化铁是一种重要的铁盐,广泛用于造纸、印染等污染处理.某研究小组采用如图所示的装置制备少量纯净的氯化铁.
氯化铁是一种重要的铁盐,广泛用于造纸、印染等污染处理.某研究小组采用如图所示的装置制备少量纯净的氯化铁.