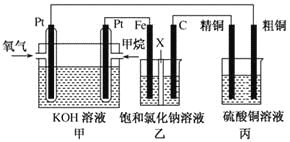
题目内容
【题目】当前,全球资源紧张、气候变暖已对人类的生存和发展形成了严峻的挑战。发展低碳经济、倡导低碳生活是形势所迫,更是大势所趋。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)工业上将CO2与焦炭作用生成CO,CO可用于炼铁,其反应原理为:
①Fe2O3(s)+3C(s)=2Fe(s)+3CO(g) ΔH1=+489.0kJ·mol-1
②C(s)+CO2(g)=2CO(g) ΔH2=+172.5 kJ·mol-1
则CO还原Fe2O3的热化学方程式为___________。
(2)适当条件下将CO2和H2以1:3的体积比混合合成甲醇和水:CO2(g)+3H2(g)CH3OH(g) +H2O(g) ΔH =-49.0 kJ·mol-1。在体积为2 L的密闭容器中,充入2 mol CO2和6 mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:

①该反应的平衡常数表达式为________。
②从反应开始到平衡,![]() (H2)=______;氢气的转化率=______;能使平衡体系中n(CH3OH)增大的措施是___________。
(H2)=______;氢气的转化率=______;能使平衡体系中n(CH3OH)增大的措施是___________。
(3)CO还可以用作燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,其负极反应式为:2CO-4e-+2![]() =4CO2,则正极反应式为__________。
=4CO2,则正极反应式为__________。
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp =3.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合(忽略混合后溶液体积的变化),若Na2CO3溶液的浓度为2×10-4mol·L-1,则生成沉淀所需CaCl2溶液的最小浓度为___________。
【答案】Fe2O3(s)+3CO(g)=2Fe(s)+ 3CO2(g) △H=-28.5KJ·mol-1 ![]() 0.225mol·L-1·min-1 75% 降低温度(或加压或增大H2的量等) O2 +2CO2+4e-=2CO32— 7.6×10-5mol·L-1
0.225mol·L-1·min-1 75% 降低温度(或加压或增大H2的量等) O2 +2CO2+4e-=2CO32— 7.6×10-5mol·L-1
【解析】
(1)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(2)①化学平衡常数指在一定温度下,可逆反应达到平衡时,各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
②根据![]() 计算反应速率;根据转化率=
计算反应速率;根据转化率=![]() 计算转化率;由于正反应是气体体积减小的放热反应,根据化学平衡移动原理分析采取的措施;
计算转化率;由于正反应是气体体积减小的放热反应,根据化学平衡移动原理分析采取的措施;
(3)原电池中正极得电子发生还原反应;
(4)根据Ksp=c(CO32-)c(Ca2+)计算沉淀时混合溶液中c(Ca2+),原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍。
(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJmol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJmol-1
依据盖斯定律①-②×3得到Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJmol-1;故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJmol-1;
(2)①根据平衡常数的定义可知该反应的平衡常数![]() ,故答案为:
,故答案为:![]() ;
;
②由图可知,10min达平衡,平衡时甲醇的浓度变化为0.75mol/L,v(CH3OH)=![]() =0.075mol/(Lmin),根据速率之比等于化学计量数之比,故v(H2)=3v(CH3OH)=3×0.075mol/(Lmin)=0.225mol/(Lmin),平衡时△n(CH3OH)=0.75mol/L×2L=1.5mol,根据方程式可知△n(H2)=3△n(CH3OH)=3×1.5mol=4.5mol,所以氢气的转化率为
=0.075mol/(Lmin),根据速率之比等于化学计量数之比,故v(H2)=3v(CH3OH)=3×0.075mol/(Lmin)=0.225mol/(Lmin),平衡时△n(CH3OH)=0.75mol/L×2L=1.5mol,根据方程式可知△n(H2)=3△n(CH3OH)=3×1.5mol=4.5mol,所以氢气的转化率为![]() ×100%=75%,该反应正反应是体积减小的放热反应,故降低温度或加压或增大H2的量等,可以使平衡向正反应移动,增大CH3OH的物质的量,故答案为:0.225mol/(Lmin),75%,降低温度(或加压或增大H2的量等);
×100%=75%,该反应正反应是体积减小的放热反应,故降低温度或加压或增大H2的量等,可以使平衡向正反应移动,增大CH3OH的物质的量,故答案为:0.225mol/(Lmin),75%,降低温度(或加压或增大H2的量等);
(3)通入氧气和CO2的混合气体一极为原电池的正极,发生还原反应,电极反应式为O2+4e-+2CO2=2CO32-,故答案为:O2+4e-+2CO2=2CO32-;
(4)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=![]() ×2×10-4mol/L=1×10-4mol/L,根据Ksp=c(CO32-)c(Ca2+)=3.8×10-9可知,c(Ca2+)=
×2×10-4mol/L=1×10-4mol/L,根据Ksp=c(CO32-)c(Ca2+)=3.8×10-9可知,c(Ca2+)=![]() mol/L=3.8×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×3.8×10-5mol/L=7.6×10-5mol/L。故答案为:7.6×10-5mol/L。
mol/L=3.8×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×3.8×10-5mol/L=7.6×10-5mol/L。故答案为:7.6×10-5mol/L。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案【题目】(1)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。已知:
C(s,石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ·mol-1
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2599 kJ·mol-1
根据盖斯定律,写出298 K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)热化学方程式:__________________________________________。
(2)在1.0 L真空密闭容器中充入4.0 mol A(g)和4.0 mol B(g),在一定温度下进行反应:A(g)+B(g)C(g) ΔH,测得不同时刻该容器内物质的物质的量如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(A)/mol | 4.0 | 2.5 | 1.5 | n2 | n3 |
n(C)/mol | 0 | 1.5 | n1 | 3 | 3 |
回答下列问题:
①随着温度的升高,该反应的化学平衡常数减小,则ΔH___(填“>”“<”或“=”)0,反应从起始到30min内A的平均反应速率是_______,该温度下,上述反应的化学平衡常数为____。
②下列选项中能说明该反应在一定温度和恒容条件下达到平衡状态的是________。
A. 反应速率:vA(正) =vC(逆) B. A的质量和C的质量相等
C. B的转化率不再改变 D. 密度不再改变
(3)若反应C(g)A(g)+B(g)进行时需加入稀释剂X气体(不参与反应),则C的平衡转化率与压强、X的物质的量的关系如图所示。
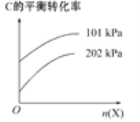
当其他条件不变时,增大X的物质的量,C的平衡转化率将________(填“增大”“减小”或“不变”),其原因是______________________________。