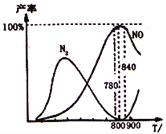
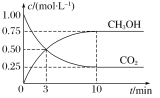
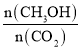题目内容
【题目】下列有关能量的叙述不正确的是
A.H2(g)的燃烧热是H=-285.8kJ/mol,则反应2H2O(g)=2H2(g)+O2(g)的反应热H=+571.6kJ/mol
B.化学键的断裂和形成是物质在化学变化中能量变化的主要原因
C.活化能的大小对化学反应前后的能量变化不产生影响
D.化学反应过程中同时存在物质变化和能量的变化
【答案】A
【解析】
A.燃烧热是1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,H元素要转化为液态水,H2(g)的燃烧热H=-285.8kJ/mol,即H2(g)+![]() O2(g)=H2O(l) H=-285.8kJ/mol,故有:2H2O(l)=2H2(g)+O2(g) H=+571.6kJ/mol,A叙述错误;
O2(g)=H2O(l) H=-285.8kJ/mol,故有:2H2O(l)=2H2(g)+O2(g) H=+571.6kJ/mol,A叙述错误;
B.化学键的断裂吸热,新化学键形成放热,化学反应中发生能量变化的主要原因是化学键的断裂和形成,B叙述正确;
C.在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞才可能发生化学反应,这些分子被称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,活化能的大小对化学反应前后的能量变化不产生影响,C叙述正确;
D.化学反应的实质是旧化学键的断裂和新化学键的形成,旧键断裂要吸收能量,新键形成的过程要放出能量,所以化学反应过程中既有物质变化又有能量变化,D叙述正确;
故选:A。

【题目】(1)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。已知:
C(s,石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ·mol-1
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2599 kJ·mol-1
根据盖斯定律,写出298 K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)热化学方程式:__________________________________________。
(2)在1.0 L真空密闭容器中充入4.0 mol A(g)和4.0 mol B(g),在一定温度下进行反应:A(g)+B(g)C(g) ΔH,测得不同时刻该容器内物质的物质的量如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(A)/mol | 4.0 | 2.5 | 1.5 | n2 | n3 |
n(C)/mol | 0 | 1.5 | n1 | 3 | 3 |
回答下列问题:
①随着温度的升高,该反应的化学平衡常数减小,则ΔH___(填“>”“<”或“=”)0,反应从起始到30min内A的平均反应速率是_______,该温度下,上述反应的化学平衡常数为____。
②下列选项中能说明该反应在一定温度和恒容条件下达到平衡状态的是________。
A. 反应速率:vA(正) =vC(逆) B. A的质量和C的质量相等
C. B的转化率不再改变 D. 密度不再改变
(3)若反应C(g)A(g)+B(g)进行时需加入稀释剂X气体(不参与反应),则C的平衡转化率与压强、X的物质的量的关系如图所示。
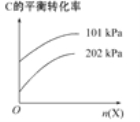
当其他条件不变时,增大X的物质的量,C的平衡转化率将________(填“增大”“减小”或“不变”),其原因是______________________________。
【题目】测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示。
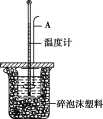
(1)理论上强酸强碱的稀溶液反应生成1 mol水时放出57.3 kJ的热量,写出表示稀硫酸和氢氧化钠稀溶液反应的中和热的热化学方程式: ____________________。
(2)仪器A的名称是 _____________;在实验过程中,如果不把温度计上的酸用水冲洗干净就直接测量NaOH溶液的温度,则测得的ΔH_____________ (填“偏大”“偏小”或“无影响”)。
(3)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白: ___________
实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3中和后生成溶液的比热容c=4.18 J/(g·℃)则中和热ΔH= _____________(取小数点后一位)
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是_____________ (填序号)。
a.实验装置保温隔热效果差
b.用量筒量取NaOH溶液的体积时仰视读数
c.分多次把NaO溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度