题目内容
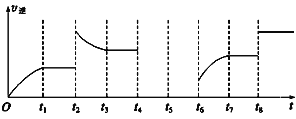
【题目】淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图1所示(加热、搅拌和仪器固定装置均已略去):实验过程如图1:
①将1:1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃90℃,保持30min, 然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入二颈烧瓶中;
③控制反应液温度在5560℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸 (65%HNO3与98%H2SO4的质量比为 2: 1.5)溶液;
④反应3h左右,冷却,减压过滤后得草酸晶体粗品,再重结晶得草酸晶体。硝酸氧化淀粉水解液过程中可发生下列反应:
⑤C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1) 实验①加入98%硫酸少许的目的是:____________。
(2) 实验中若混酸滴加过快,将导致草酸产量下降,其原因是____________。
(3) 装置B的作用是________,为使尾气充分吸收,C中试剂是____________。
(4) 重结晶时,将草酸晶体粗品经①加热溶解、②趁热过滤、③冷却结晶、④过滤洗涤、⑤干燥等实验步骤,得到较纯净的草酸晶体。该过程中可将粗品中溶解度较大的杂质在_____(填上述步骤序号)时除去;
(5)将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸。
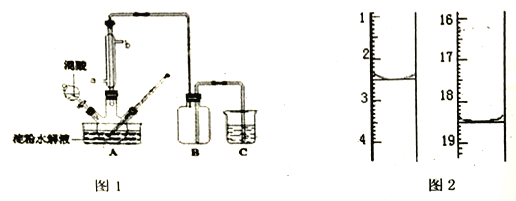
用酸性KMnO4标准溶液滴定,该反应的离子方程式为:____________,称取该样品加适量水完全溶解,然后用0.02000mol/L的酸性KMnO4溶液滴定至终点(杂质不参与反应),滴定前后滴定管中的液面读数如图2,则消耗KMnO4溶液的体积为____________。
【答案】 加快淀粉水解的速度(或起到催化剂的作用) 温度过高,硝酸浓度过大,导致H2C2O4进一步被氧化 作安全瓶 NaOH溶液 ④ 2MnO4+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 16.00mL
【解析】(1)浓硫酸具有强氧化性、吸水性和脱水性,本题实验是将C6H12O6用硝酸氧化可以制备草酸,浓硫酸作催化剂且浓硫酸吸水有利于向生成草酸的方向移动,故答案为:加快淀粉水解的速度(或起到催化剂的作用);
(2)混酸为65%HNO3与98%H2SO4的混合液,混合液溶于水放热,温度高能加快化学反应,硝酸能进一步氧化H2C2O4成二氧化碳,故答案为:温度过高,硝酸浓度过大,导致H2C2O4进一步被氧化;
(3)装置B的作用是防止发生装置和吸收装置间发生倒吸,起到安全瓶的作用,反应的尾气中有氮的氧化物,会污染空气,需要用氢氧化钠溶液吸收,所以C中试剂是NaOH溶液,故答案为:作安全瓶;NaOH溶液;
(4)根据题中实验步骤可知,通过重结晶得草酸晶体时,草酸晶体析出,溶解度较大的杂质留在溶液中,应该在步骤④中除去,溶解度较小的杂质最后过滤时留在滤纸上,故答案为:④;
(5)在酸性条件下,高锰酸根离子能和草酸发生氧化还原反应生成二价锰离子、二氧化碳和水,离子方程式为2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O,图示滴定管消耗溶液体积为:18.50mL-2.50mL=16.00mL,故答案为:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O;16.00mL。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】MnSO4在工业中有重要应用,用软锰矿浆(主要成分为MnO2和水,含有Fe2O3、FeO、Al2O3和少量PbO等杂质)浸出制备MnSO4,其过程如下:


【资料】部分阳离子形成氢氧化物沉淀的pH
离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Pb2+ |
开始沉淀时的pH | 7.6 | 2.7 | 3.8 | 8.3 | 8.0 |
完全沉淀时的pH | 9.7 | 3.7 | 4.7 | 9.8 | 8.8 |
(1)向软锰矿浆中通入SO2生成MnSO4,该反应的化学方程是___________。
(2)加入MnO2的主要目的是___________;
(3)在氧化后的液体中加入石灰浆,用于调节pH,pH应调至____范围,生成的沉淀主要含有____和少量CaSO4。
(4) 阳离子吸附剂可用于主要除去的离子是______________。
(5) 用惰性电极电解MnSO4溶液,可以制得高活性MnO2。电解MnSO4、ZnSO4和H2SO4的混合溶液可制备MnO2和Zn,写出阳极的电极反应方程式________________。