题目内容
17.设计一种以铁和氯化铁反应为原理的原电池,要求画出装置图:(标明电极材料、电解质溶液、电池的正负极及电子流动的方向.)
分析 由方程式可知,Fe被氧化,为原电池的负极,则正极可为碳棒或者铜,电解质溶液为氯化铁溶液,正极发生还原反应,负极发生氧化反应,以此解答该题.
解答 解:由方程式Fe+2FeCl3=3FeCl2可知,Fe被氧化,为原电池的负极,负极反应为fE-2e-=Fe2+,正极Fe3+被还原,电极方程式为2Fe3++2e-=2Fe2+,
则正极可为碳棒或者铜,电解质溶液为氯化铁,
则原电池装置图可设计为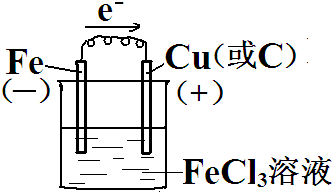 ,
,
答:原电池为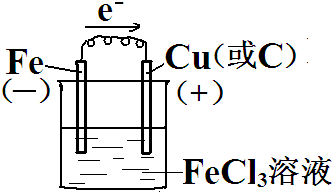 .
.
点评 本题考查了原电池的设计,原电池的设计关键是负极材料和电解质溶液的成分,一般来说,还原剂作负极,不如负极活泼的金属或非金属导体作正极,氧化剂的溶液作电解质溶液.

练习册系列答案
相关题目
7.下列各组物质,不能用分液漏斗分离的是( )
| A. | 乙酸乙酯和水 | B. | 溴苯和水 | C. | 苯和甲苯 | D. | 硝基苯和水 |
5.下列有关化学反应的说法中,不正确的是( )
| A. | 化学反应一定伴随能量变化 | |
| B. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| C. | 放热反应中反应物的总能量大于生成物的总能量 | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
12.下表是元素周期表的一部分,用元素符号或化学式填空回答:
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为 ;
;
(2)写出①元素的单质分子的电子式 ;用电子式表示元素②与⑪化合物的形成过程
;用电子式表示元素②与⑪化合物的形成过程 ,该化合物属于共价(填“共价”或“离子”)化合物.
,该化合物属于共价(填“共价”或“离子”)化合物.
(3)碱性最强的化合物的电子式是: ;
;
(4)②元素氢化物在常温下和③发生反应所得溶液的pH>7
(5)元素③与 ⑩形成化合物的化学式是NaCl,高温灼烧该化合物时,火焰呈黄色.
(6)元素⑦与⑩两者核电荷数之差是18.
(7)比较元素⑦、⑨、⑩原子的半径大小K>Br>Cl
(8)③④⑤单质的活泼性顺序为:Na>Mg>Al(从大到小,判断的实验依据是:与酸反应的剧烈程度(任写一种)
(9)请设计一个实验方案,比较⑦和⑩单质氧化性的强弱:Cl2+2Br-=Br2+2Cl-.
| 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VⅡA | 0 |
| 二 | ⑪ | ① | ② | |||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 ;
;(2)写出①元素的单质分子的电子式
 ;用电子式表示元素②与⑪化合物的形成过程
;用电子式表示元素②与⑪化合物的形成过程 ,该化合物属于共价(填“共价”或“离子”)化合物.
,该化合物属于共价(填“共价”或“离子”)化合物.(3)碱性最强的化合物的电子式是:
 ;
;(4)②元素氢化物在常温下和③发生反应所得溶液的pH>7
(5)元素③与 ⑩形成化合物的化学式是NaCl,高温灼烧该化合物时,火焰呈黄色.
(6)元素⑦与⑩两者核电荷数之差是18.
(7)比较元素⑦、⑨、⑩原子的半径大小K>Br>Cl
(8)③④⑤单质的活泼性顺序为:Na>Mg>Al(从大到小,判断的实验依据是:与酸反应的剧烈程度(任写一种)
(9)请设计一个实验方案,比较⑦和⑩单质氧化性的强弱:Cl2+2Br-=Br2+2Cl-.
2.一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳,2CH3OH(g)+3O2(g)=4H2O(1)+2CO2(g)( )
| A. | 该电池中通入甲醇的电极为电源的正极 | |
| B. | 氧气被还原 | |
| C. | 当导线中通过4mol电子时,消耗甲醇的物质的量为1mol | |
| D. | 溶液中的H+向通甲醇的电极运动 |
9.下列物质中,不能使酸性KMnO4溶液褪色的是( )
①乙烯 ②甲烷 ③乙苯 ④乙炔 ⑤苯酚 ⑥甲苯 ⑦苯 ⑧乙醇.
①乙烯 ②甲烷 ③乙苯 ④乙炔 ⑤苯酚 ⑥甲苯 ⑦苯 ⑧乙醇.
| A. | ②③④⑥ | B. | ②③④⑤⑥⑦⑧ | C. | ②④⑦ | D. | ②⑦ |
6.下列有关元素周期表的说法中,错误的是( )
| A. | 主族元素分布于短周期和长周期里,而副族元素仅分布于长周期里 | |
| B. | 元素周期表中,位于同一主族的元素的原子最外层电子数相同,且等于族序数 | |
| C. | 元素周期表中,周期的序数就是该周期元素原子具有的电子层数 | |
| D. | 元素周期表有7个横行,7个周期;18个纵列,18个族 |
20.某高分子化合物R的结构简式为 ,下列有关R的说法正确的是( )
,下列有关R的说法正确的是( )
 ,下列有关R的说法正确的是( )
,下列有关R的说法正确的是( )| A. | R的一种单体的分子式可能为C9H10O2 | |
| B. | R完全水解后生成物均为小分子有机物 | |
| C. | 可以通过加聚反应和缩聚反应合成R | |
| D. | 碱性条件下,1 mol R完全水解消耗NaOH的物质的量为2 mol |