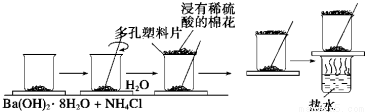
题目内容
5.下列有关化学反应的说法中,不正确的是( )| A. | 化学反应一定伴随能量变化 | |
| B. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| C. | 放热反应中反应物的总能量大于生成物的总能量 | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
分析 A、化学变化是旧键的断裂和新键的形成过程,断键成键都有能量变化;
B、根据化学反应中实质是化学键的断裂和形成;
C、根据能量守恒判断;
D、反应吸热放热与反应条件无关,决定于反应物和生成物的能量高低.
解答 解:A、化学变化是旧键的断裂和新键的形成过程,断键吸热成键放热,所以物质发生化学反应都伴随着能量变化,故A正确;
B、因化学反应中能量变化的主要原因是化学键的断裂和形成,故B正确;
C、反应物的总能量高于生成物的总能量,多余的热量以热量的形式放出去,所以为放热反应,故C正确;
D、燃烧需要加热到着火点,但是放热反应,所以经过加热而发生的化学反应不一定是吸热反应,故D错误.
故选:D.
点评 本题主要考查化学反应中能量变化的原因,注意反应吸热还是放热与反应条件无关,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.2003年,IUPAC(国际纯粹与应用化学联合会)推荐原子序数为110的元素的符号为Ds,以纪念该元素的发现地(Darmstadt,德国).下列关于Ds的说法不正确的是( )
| A. | Ds原子在周期表中位于第7周期第ⅦB族 | |
| B. | Ds是过渡元素 | |
| C. | Ds原子的核外电子数为110 | |
| D. | Ds为金属元素 |
13.下列说法正确的是( )
| A. | 放热反应一定是断开反应物中的化学键吸收的能量比形成生成物中的化学键放出的能量少 | |
| B. | 1molH2SO4和1molBa(OH)2完全反应所放出的热量称为中和热 | |
| C. | 反应物的总能量低于生成物的总能量的化学反应为放热反应 | |
| D. | 在化学反应中需要加热的反应就是吸热反应 |
10.下列关于F、Cl、Br、I性质的比较,不正确的是( )
| A. | 它们的原子核外电子层数随核电荷数的增加而增多 | |
| B. | 它们的熔沸点随核电荷数的增加而增加 | |
| C. | 它们的氢化物的稳定性随核电荷数的增加而增强 | |
| D. | 单质的颜色随核电荷数的增加而加深 |
14.A、B、C都是金属:B中混有C时,只有C能被盐酸溶解;A与B组成原电池时,A为电池的正极.A、B、C三种金属的活动性顺序为( )
| A. | C>B>A | B. | B>C>A | C. | A>B>C | D. | A>C>B |
8.已知:在一定温度下,微溶电解质Ca(OH)2在饱和溶液中建立沉淀溶解平衡:Ca(OH)2(s)?Ca2++2OH-,浓度积常数Ksp=c(Ca2+)•c2(OH-).下列有关说法不正确的是( )
| A. | 饱和石灰水中加入生石灰,若保持温度不变,则pH不变 | |
| B. | 升高饱和石灰水的温度时,Ca(OH)2溶度积常数Ksp减小 | |
| C. | 饱和石灰水中加入生石灰,若保持温度不变,则溶液中Ca2+的物质的量不变 | |
| D. | 向饱和石灰水中加入浓CaCl2溶液会有Ca(OH)2沉淀析出 |
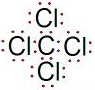 ,空间构型为正四面体.
,空间构型为正四面体.