题目内容
【题目】Ⅰ.化工工业中常用乙苯脱氢的方法制备苯乙烯。已知某温度下:
反应①:CO2(g) +H2 (g)→CO(g) + H2O(g),ΔH= +41.2 kJ/mol
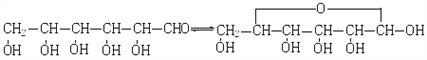
反应②:![]() (g)→
(g)→![]() (g)+H2(g),ΔH= +117.6kJ/mol
(g)+H2(g),ΔH= +117.6kJ/mol
②的化学反应平衡常数分别为K1、K2。
(1)请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式__________________。该反应的化学平衡常数K=_________(用K1、K2表示)。
(2)温恒容条件下,反应①达到平衡后;t1时刻通入少量CO2;请在下图中画出t1之后的正逆反应曲线,并作出标注。__________________
Ⅱ.一定条件下,合成氨反应为:如图表示在此反应过程中的能量的变化,如图表示在2L的密闭中反应时N2的物质的量随时间的变化曲线.如图表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
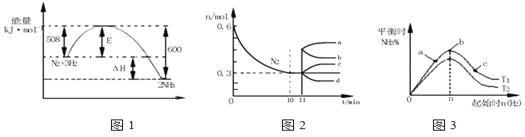
(3)由如图信息,计算10min内该反应的平均速率v(H2)=______,从11min起其它条件不变,压缩容器的体积,则n(N2)的变化曲线为____(填“a”或“b”或“c”或“d”)
(4)如图a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是____点,温度T1____T2(填“>”或“=”或“<”)
Ⅲ.H2O2是一种常用绿色氧化剂,工业上利用电解法制备H2O2的装置如图所示:

(5)a为______(正极、负极)
(6)通入空气的电极反应式为__________
【答案】 CO2(g)+ (g)+CO(g)+H2O(g)△H=+158.8 kJ/mol K=K1·K2
(g)+CO(g)+H2O(g)△H=+158.8 kJ/mol K=K1·K2  0.045mol/(L·min) d c < 正极 O2+2H2O+2e=H2O2+2OH-
0.045mol/(L·min) d c < 正极 O2+2H2O+2e=H2O2+2OH-
【解析】本题分析:本题主要考查化学平衡。
Ⅰ. (1)①+②可得二氧化碳氧化乙苯制备苯乙烯的热化学方程式:
CO2(g)+ (g)+CO(g)+H2O(g)△H=+158.8 kJ/mol 。
(g)+CO(g)+H2O(g)△H=+158.8 kJ/mol 。
该反应的化学平衡常数K=K1K2。
(2)t1时刻通入少量CO2, t1之时刻正反应速率增大,逆反应速率不变,t1后正反应速率减小,逆反应速率增大。t1之后的正逆反应曲线为:

Ⅱ. (3)v(H2)=3v(N2)=(0.3/2/10×3)mol/(L·min)=0.045mol/(L·min)。从11min起其它条件不变,压缩容器的体积,加压平衡右移,n(N2)减小,则n(N2)的变化曲线为d。
(4)因为增大氢气浓度可以提高氮气的转化率,所以反应物N2的转化率最高的是c点。因为升温平衡左移,氮气的转化率降低,所以温度T1<T2。
Ⅲ.(5)连接a电极的电极发生氧化反应,所以a为正极。
(6)通入空气的电极反应式为O2+2H2O+2e=H2O2+2OH-。

 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案