题目内容
【题目】金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca,并含有3.5%(质量分数)CaO。
(1)Ca元素在周期表中位置是_________,其原子结构示意图_________。
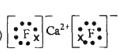
(2)Ca与最活跃的非金属元素A形成化合物D,D的电子式为_________。
(3)将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,则金属M为______;检测Mn+的方法是_______________________________________(用离子方程式表达)。
(4)取1.6g钙线试样,与水充分反映,生成224ml.H2(标准状况),在想溶液中通入适量的CO2,最多能得到CaCO3_____________g。
【答案】 第四周期第ⅡA族 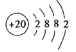
 Fe Fe3++3SCN-=Fe(SCN)3 1.1g
Fe Fe3++3SCN-=Fe(SCN)3 1.1g
【解析】(1)Ca是20号元素,钙原子核外电子数为20,有3个电子层,各层电子数为2、8、8、1,处于周期表中第四周期第ⅡA族,原子结构示意图为 ,故答案为:第四周期第ⅡA族;
,故答案为:第四周期第ⅡA族; ;(2)最活跃的非金属元素A为F元素,钙与氟形成氟化钙,为离子化合物,电子式为
;(2)最活跃的非金属元素A为F元素,钙与氟形成氟化钙,为离子化合物,电子式为![]() ;(3)钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,M为Fe元素,Fe3+与SCN-结合生成红色物质检验Fe3+,离子方程式为Fe3++3SCN-=Fe(SCN)3;(4)224mlH2的物质的量为
;(3)钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,M为Fe元素,Fe3+与SCN-结合生成红色物质检验Fe3+,离子方程式为Fe3++3SCN-=Fe(SCN)3;(4)224mlH2的物质的量为![]() =0.01mol,钙与水反应生成氢氧化钙与氢气,根据电子转移守恒可知,Ca的物质的量为
=0.01mol,钙与水反应生成氢氧化钙与氢气,根据电子转移守恒可知,Ca的物质的量为![]() =0.01mol,样品中CaO质量分数为3.5%,故氧化钙的质量为1.6g×3.5%=0.056g,故氧化钙的物质的量为
=0.01mol,样品中CaO质量分数为3.5%,故氧化钙的质量为1.6g×3.5%=0.056g,故氧化钙的物质的量为![]() =0.001mol,氧化钙与水反应生成氢氧化钙,氢氧化钙与二氧化碳反应生成碳酸钙,根据钙元素守恒可知生成的n(CaCO3)=n(Ca)+n(CaO)=0.01mol+0.001mol=0.011mol,碳酸钙的质量为0.011mol×100g/mol=1.1g
=0.001mol,氧化钙与水反应生成氢氧化钙,氢氧化钙与二氧化碳反应生成碳酸钙,根据钙元素守恒可知生成的n(CaCO3)=n(Ca)+n(CaO)=0.01mol+0.001mol=0.011mol,碳酸钙的质量为0.011mol×100g/mol=1.1g

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案【题目】常温下,将某一元酸HX和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
试验编号 | HX的物质的量浓度(mol/L) | NaOH的物质的量浓度(mol/L) | 混合溶液的PH |
甲 | 0.2 | 0.2 | PH=a |
乙 | c1 | 0.2 | PH=7 |
丙 | 0.2 | 0.2 | PH>7 |
丁 | c2 | c3 | PH=10 |
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,若a________7(填“>”“<”或“=”),则HX为强酸;若a________7(填“>”“<”或“=”),则HX为弱酸.
(2)在乙组混合溶液中离子浓度c(X-)与c(Na+)的大小关系是________.
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)丙溶液中离子浓度由大到小的顺序是_____________________________.
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________mol/L.
【题目】浓硫酸与蔗糖反应的实验,对现象的解释不合理的是
选项 | 现象 | 解释 |
A | 蔗糖变黑 | 浓硫酸具有脱水性 |
B | 有刺激性气味 | 浓硫酸具有强酸性 |
C | 固体体积膨胀 | 生成大量气体 |
D | 烧杯壁发烫 | 反应放热 |
A. A B. B C. C D. D