题目内容
11.已知,H2和I2反应的历程为:①I2+M?2I•+M慢 ②H2+2I•→2HI快式中M是指反应器壁或其他惰性分子,不参与反应,只具有传递能量的作用.下列关于该反应的说法正确的是( )| A. | 反应速率与I•的浓度有关 | B. | M是该反应的催化剂 | ||
| C. | 反应①与②的活化能相等 | D. | v(H2)=v(I2)=v(HI) |
分析 A.化学反应的反应速率取决于反应速率最慢的反应,据反应来回答;
B.催化剂在最初的反应中参加反应、在最终的反应中生成;
C.不同反应的活化能大小是不一样的;
D.同一可逆反应中,反应速率之比等于其计量数之比,据此回答.
解答 解:A.化学反应的反应速率取决于反应速率最慢的反应,所以该反应的速率主要由①决定,与I•的浓度有关,故A正确;
B.催化剂在最初的反应中参加反应、在最终的反应中生成,M不具备该条件,所以不能是催化剂,故B错误;
C.不同反应的活化能大小是不一样的,①与②的活化能不相等,故C错误;
D.同一可逆反应中,反应速率之比等于其计量数之比,该反应方程式为H2(g)+2ICl(g)=2HCl(g)+I2,所以反应速率2v(H2)=v(HI)=2v(I2),故D错误;
故选A.
点评 本题考查化学反应机理,侧重考查学生分析判断能力,涉及反应速率快慢判断、决定因素及催化剂等知识点,易错选项是B,题目难度中等.

练习册系列答案
相关题目
1.1,2-二甲基环己烷(  )的一氯代产物有(不考虑立体异构)( )
)的一氯代产物有(不考虑立体异构)( )
 )的一氯代产物有(不考虑立体异构)( )
)的一氯代产物有(不考虑立体异构)( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
2.下列各项中,不能说明2HI?H2+I2(g)已经达到平衡状态的是( )
| A. | 单位时间内,生成nmolH2的同时生成nmolHI | |
| B. | 一个H-H键断裂的同时,有2个H-I键断裂 | |
| C. | 温度和体积一定时,某一生成物浓度不再变化 | |
| D. | 温度和体积一定时,混合气体的颜色不再变化 |
19.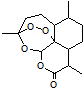 2015年,中国药学家屠呦呦获得诺贝尔生理学或医学奖,其突出贡献是创制新型抗疟药青蒿素和双氢青蒿素.已知青蒿素的结构如图所示,有关青蒿素的说法,不正确的是( )
2015年,中国药学家屠呦呦获得诺贝尔生理学或医学奖,其突出贡献是创制新型抗疟药青蒿素和双氢青蒿素.已知青蒿素的结构如图所示,有关青蒿素的说法,不正确的是( )
 2015年,中国药学家屠呦呦获得诺贝尔生理学或医学奖,其突出贡献是创制新型抗疟药青蒿素和双氢青蒿素.已知青蒿素的结构如图所示,有关青蒿素的说法,不正确的是( )
2015年,中国药学家屠呦呦获得诺贝尔生理学或医学奖,其突出贡献是创制新型抗疟药青蒿素和双氢青蒿素.已知青蒿素的结构如图所示,有关青蒿素的说法,不正确的是( )| A. | 分子式为C15H22O5 | |
| B. | 能够发生水解反应 | |
| C. | 每个分子中含有4个六元环 | |
| D. | 青蒿素能够治疗疟疾可能与结构中存在过氧键基团有关 |
6.氮、碳都是重要的非金属元素,含氮、碳元素的物质在工业生产中有重要的应用.
(1)请写出工业上由NH3制取NO的化学方程式4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$ 4NO+6H2O.
(2)一定条件下,铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),已知该反应的平衡常数K与温度T的关系如图所示.
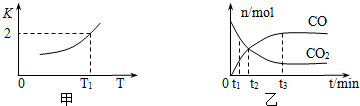
①该反应的逆反应是放热(填“吸热”或“放热”)反应.
②T℃、P pa压强下,在体积为VL的容器中进行反应,下列能说明反应达到平衡状态的是A.
A、混合气体的平均相对分子质量不再变化;
B、容器内压强不再变化;
C、v正(CO2)=v逆(FeO)
③T1温度下,向体积为V L的密闭容器中加入足量铁粉并充入一定量的CO2,反应过程中CO和CO2物质的量与时间的关系如图乙所示.则CO2的平衡转化率为$\frac{2}{3}$,平衡时混合气体的密度与起始时气体的密度之比为$\frac{25}{33}$.
(3)在恒温条件下,起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2+3H2?2NH3,有关数据及平衡状态特定见表.
起始时乙容器中的压强是甲容器的0.8倍.
(4)一定条件下,2.24L(折算为标准状况)N2O和CO的混合气体在点燃条件恰好完全反应,放出bkJ热量.生成的3种产物均为大气组成气体,并测得反应后气体的密度是反应前气体密度的 $\frac{6}{7}$倍.请写出该反应的热化学方程式4N2O(g)+2CO(g)═4N2(g)+2CO2(g)+O2(g)△H=-60bkJ•mol-1.
(1)请写出工业上由NH3制取NO的化学方程式4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$ 4NO+6H2O.
(2)一定条件下,铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),已知该反应的平衡常数K与温度T的关系如图所示.

①该反应的逆反应是放热(填“吸热”或“放热”)反应.
②T℃、P pa压强下,在体积为VL的容器中进行反应,下列能说明反应达到平衡状态的是A.
A、混合气体的平均相对分子质量不再变化;
B、容器内压强不再变化;
C、v正(CO2)=v逆(FeO)
③T1温度下,向体积为V L的密闭容器中加入足量铁粉并充入一定量的CO2,反应过程中CO和CO2物质的量与时间的关系如图乙所示.则CO2的平衡转化率为$\frac{2}{3}$,平衡时混合气体的密度与起始时气体的密度之比为$\frac{25}{33}$.
(3)在恒温条件下,起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2+3H2?2NH3,有关数据及平衡状态特定见表.
| 容器 | 起始投入 | 达平衡时 | |||
| 甲 | 2mol N2 | 3mol H2 | 0mol NH3 | 1.5mol NH3 | 同种物质的体积分数相同 |
| 乙 | a mol N2 | b mol H2 | 0mol NH3 | 1.2mol NH3 | |
(4)一定条件下,2.24L(折算为标准状况)N2O和CO的混合气体在点燃条件恰好完全反应,放出bkJ热量.生成的3种产物均为大气组成气体,并测得反应后气体的密度是反应前气体密度的 $\frac{6}{7}$倍.请写出该反应的热化学方程式4N2O(g)+2CO(g)═4N2(g)+2CO2(g)+O2(g)△H=-60bkJ•mol-1.
3.化学与人类生产、生活密切相关,下列有关说法正确的是( )
| A. | 14C可用于文物年代的鉴定,14C与12C互为同素异形体 | |
| B. | 绚丽缤纷的烟花与原子核外电子发生跃迁吸收能量有关 | |
| C. | 叶绿素、血红素和维生素B12都是配合物 | |
| D. | 当单一波长的X-射线通过石英玻璃时,在记录仪上可看到分立的斑点或谱线 |
 ⑤-CHO ⑥-H.
⑤-CHO ⑥-H. .
.