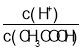题目内容
【题目】醋酸与醋酸钠组成的缓冲溶液对酸碱有一定的缓冲作用,缓冲能力与组分的浓度有关。室温时下列指定溶液中微粒物质的量浓度关系正确的是
A.0.1 mol·L1 CH3COOH溶液:c(CH3COOH)> c(CH3COO-) > c(H+)>c(OH-)
B.pH=8的CH3COOH和CH3COONa混合溶液:c(Na+)﹣c(CH3COO-) =9.9×10-7 mol·L-1
C.0.1 mol·L1CH3COOH溶液和0.2 mol·L-1CH3COONa溶液等体积混合:2c(Na+)= 3c(CH3COO-)+3c(CH3COOH)
D.0.2 mol·L-1CH3COOH溶液和0.1 mol·L-1NaOH溶液等体积混合:c(CH3COOH)+ 2c(H+)=c(CH3COO-)+2c(OH-)
【答案】BD
【解析】
A. 0.1 mol·L1 CH3COOH溶液中,电离方程式为:CH3COOH![]() CH3COO-+H+、H2O
CH3COO-+H+、H2O![]() H++OH-,溶液中的H+有两个来源,显然,c(H+)> c(CH3COO-),A错误;
H++OH-,溶液中的H+有两个来源,显然,c(H+)> c(CH3COO-),A错误;
B. CH3COOH和CH3COONa混合溶液,pH=8,说明以CH3COO-的水解为主,溶液中发生的反应为:CH3COO-+H2O![]() CH3COOH+OH-、H2O
CH3COOH+OH-、H2O![]() H++OH-,c(Na+)﹣c(CH3COO-) = c(OH-)- c(H+)=9.9×10-7 mol·L-1,B正确;
H++OH-,c(Na+)﹣c(CH3COO-) = c(OH-)- c(H+)=9.9×10-7 mol·L-1,B正确;
C. 0.1 mol·L1CH3COOH溶液和0.2 mol·L-1CH3COONa溶液等体积混合:2c(Na+)=0.2mol·L-1,3c(CH3COO-)+3c(CH3COOH)=3(0.05mol·L1+0.1 mol·L-1)=0.45mol·L-1,显然2c(Na+)≠ 3c(CH3COO-)+3c(CH3COOH),C错误;
D. 0.2 mol·L-1CH3COOH溶液和0.1 mol·L-1NaOH溶液等体积混合,发生反应,所得溶液中c(CH3COOH)= 0.05mol·L1,c(CH3COO-)= 0.05mol·L1;反应后的溶液中存在下列平衡:CH3COOH![]() CH3COO-+H+、H2O
CH3COO-+H+、H2O![]() H++OH-,c(CH3COO-)-(CH3COOH)= 2[c(H+)=c(OH-)],从而得出:c(CH3COOH)+ 2c(H+)=c(CH3COO-)+2c(OH-),D正确;
H++OH-,c(CH3COO-)-(CH3COOH)= 2[c(H+)=c(OH-)],从而得出:c(CH3COOH)+ 2c(H+)=c(CH3COO-)+2c(OH-),D正确;
故选BD。

 新思维寒假作业系列答案
新思维寒假作业系列答案【题目】叠氮化钠(NaN3)是汽车安全气囊最理想的气体发生剂原料。下面是工业水合肼法制备叠氮化钠的工艺流程:

查阅资料:
①水合肼(N2H4·H2O)有毒且不稳定,具有强还原性和强碱性。
②有关物质的物理性质如下表:
物质 | 熔点℃ | 沸点℃ | 溶解性 |
CH3OH | -97 | 64.7 | 与水互溶 |
水合肼(N2H4·H2O) | -40 | 118.5 | 与水、醇互溶,不溶于乙醚 |
亚硝酸甲酯(CH3ONO) | -17 | -12 | 溶于乙醇、乙醚 |
叠氮化钠(NaN3) | 275 (410易分解) | —— | 易溶于水,微溶于醇, 不溶于乙醚 |
(1)合成水合肼。
实验室合成水合肼装置如图所示。NaClO碱性溶液与尿素CO(NH2)2水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应可以制得水合肼。
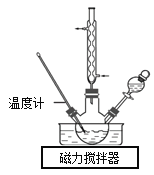
①制取N2H4·H2O的离子方程式为_________。
②实验中通过分液漏斗滴加的溶液是_________,理由是_________。
(2)水合肼法制备叠氮化钠。
①实验室模拟工艺流程步骤Ⅰ制备叠氮化钠的反应原理为:N2H4·H2O(aq)+CH3ONO(g)+NaOH(aq)=NaN3(aq)+CH3OH(aq)+3H2O(l) △H﹤0, 研究表明该反应在20℃左右反应的选择性和转化率最高,实验时可以采取的措施是_________。
②步骤Ⅱ回收CH3OH的实验操作名称为________。
③请设计由B溶液获得叠氮化钠(NaN3)产品的实验方案:_________[实验中可供选择的试剂有:乙醇、乙醚;除常用仪器外须使用的仪器有:布氏漏斗、真空干燥箱]。
【题目】I.某学生用0.100molL-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3cm 处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
实验编号 | KOH溶液的浓度(mol/L) | 滴定完成时,KOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)_____。
(2)根据上述数据,可计算出该盐酸的浓度约为_____(保留两位有效数字)
II.亚硫酸盐是一种常见食品添加剂。为检验某食品中亚硫酸盐含量(通常以1kg样品中含SO2的质量计),某研究小组用“碘氧化还原滴定法”进行测定,实验流程如下:

(1)碘标准液应选用____(填“酸式”或“碱式”)滴定管盛装,加注标准液之前必须对滴定管进行_____、洗涤、____。
(2)锥形瓶内的指示剂为_____,判断达到滴定终点的依据是________。
(3)下列操作会使测定结果偏大的有(_______)
A.起始读数时平视,终点读数时俯视
B.未用标准液润洗滴定管
C.步骤①中用稀盐酸代替稀硫酸
(4)若取样品w g,按乙方案测得消耗0.01000mol·L-1 I2溶液VmL,则1kg样品中含SO2的质量是____g(用含w、V的代数式表示)。