题目内容
【题目】叠氮化钠(NaN3)是汽车安全气囊最理想的气体发生剂原料。下面是工业水合肼法制备叠氮化钠的工艺流程:

查阅资料:
①水合肼(N2H4·H2O)有毒且不稳定,具有强还原性和强碱性。
②有关物质的物理性质如下表:
物质 | 熔点℃ | 沸点℃ | 溶解性 |
CH3OH | -97 | 64.7 | 与水互溶 |
水合肼(N2H4·H2O) | -40 | 118.5 | 与水、醇互溶,不溶于乙醚 |
亚硝酸甲酯(CH3ONO) | -17 | -12 | 溶于乙醇、乙醚 |
叠氮化钠(NaN3) | 275 (410易分解) | —— | 易溶于水,微溶于醇, 不溶于乙醚 |
(1)合成水合肼。
实验室合成水合肼装置如图所示。NaClO碱性溶液与尿素CO(NH2)2水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应可以制得水合肼。
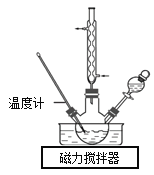
①制取N2H4·H2O的离子方程式为_________。
②实验中通过分液漏斗滴加的溶液是_________,理由是_________。
(2)水合肼法制备叠氮化钠。
①实验室模拟工艺流程步骤Ⅰ制备叠氮化钠的反应原理为:N2H4·H2O(aq)+CH3ONO(g)+NaOH(aq)=NaN3(aq)+CH3OH(aq)+3H2O(l) △H﹤0, 研究表明该反应在20℃左右反应的选择性和转化率最高,实验时可以采取的措施是_________。
②步骤Ⅱ回收CH3OH的实验操作名称为________。
③请设计由B溶液获得叠氮化钠(NaN3)产品的实验方案:_________[实验中可供选择的试剂有:乙醇、乙醚;除常用仪器外须使用的仪器有:布氏漏斗、真空干燥箱]。
【答案】ClO- + CO(NH2)2 +2OH- = Cl- + N2H4·H2O +![]() NaClO碱性溶液 防止过量的NaClO溶液将水合肼氧化 20℃(冷)水浴(或缓慢通入CH3ONO气体) 蒸馏 蒸发浓缩、(冷却)结晶,用布氏漏斗抽滤(过滤),晶体用乙醇洗涤2~3次,真空干燥箱干燥
NaClO碱性溶液 防止过量的NaClO溶液将水合肼氧化 20℃(冷)水浴(或缓慢通入CH3ONO气体) 蒸馏 蒸发浓缩、(冷却)结晶,用布氏漏斗抽滤(过滤),晶体用乙醇洗涤2~3次,真空干燥箱干燥
【解析】
(1)①NaClO的碱性溶液与尿素CO(NH2)2水溶液反应生成N2H4·H2O,NaCl、Na2CO3,据此写出离子方程式;
②因为水合肼具有强还原性,易被次氯酸钠溶液氧化,可以通过分液漏斗控制NaClO碱性溶液的滴加速度,以此控制用量;
(2)①该反应在20℃左右反应的选择性和转化率最高,所以应设法把温度控制在20℃左右,据此分析实验时可以采取的措施;
②从混合液中可以采用蒸馏的方法回收甲醇;
③由B溶液获得叠氮化钠(NaN3)产品,需考虑先让叠氮化钠从溶液中结晶析出(蒸发浓缩、(冷却)结晶),过滤(布氏漏斗),洗涤(易溶于水,需采用非水洗液,常用乙醇,不使用乙醚,是因为还要考虑杂质离子的去除及环境保护),烘干(具有强还原性,需考虑隔绝空气)。
①NaClO碱性溶液与尿素CO(NH2)2水溶液制取N2H4·H2O,则反应物为ClO-、OH-、CO(NH2)2,生成物为N2H4·H2O、Cl-、CO32-(C由+2价被氧化为+4价的CO2,再与OH-反应),反应的离子方程式为ClO- + CO(NH2)2 +2OH- = Cl- + N2H4·H2O +![]() 。
。
答案为:ClO- + CO(NH2)2 +2OH- = Cl- + N2H4·H2O +![]() ;
;
②因为水合肼具有强还原性,防止过量的NaClO溶液将水合肼氧化,所以需控制NaClO的用量,实验中通过分液漏斗滴加的溶液是NaClO碱性溶液;
答案为:防止过量的NaClO溶液将水合肼氧化;
(2)①该反应在20℃左右反应的选择性和转化率最高,所以应设法把温度控制在20℃左右,实验时可以采取的措施是20℃(冷)水浴(或缓慢通入CH3ONO气体);
答案为:20℃(冷)水浴(或缓慢通入CH3ONO气体);
②步骤Ⅱ为从溶液中回收CH3OH,则其实验操作名称为蒸馏;
答案为:蒸馏;
③由B溶液获得叠氮化钠(NaN3)产品,需考虑先让叠氮化钠从溶液中结晶析出(蒸发浓缩、(冷却)结晶),过滤(布氏漏斗),洗涤(易溶于水,需采用非水洗液,常用乙醇,不使用乙醚,是因为还要考虑杂质离子的去除及环境保护),烘干(具有强还原性,需考虑隔绝空气);
答案为:蒸发浓缩、(冷却)结晶,用布氏漏斗抽滤(过滤),晶体用乙醇洗涤2~3次,真空干燥箱干燥。