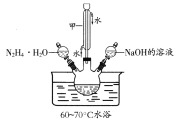
题目内容
【题目】下列说法正确的是
A.1 mol N2与4 mol H2混合充分反应,则反应中转移的电子数目为6 mol
B.反应2Mg(s)+CO2(g)= C(s)+2MgO(s) 能自发进行,则该反应的ΔH>0
C.向0.1 mol·L1 CH3COONa溶液中加入少量水,溶液中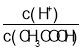 减小
减小
D.在稀溶液中:H+(aq)+OH-(aq)= H2O(l) ΔH= -57.3kJ·mol1,若将含0.5 mol H2SO4的浓硫酸与1 L 1.0 mol·L1 的NaOH溶液混合,放出的热量大于57.3 kJ
【答案】D
【解析】
A.因为N2与H2的反应为可逆反应,所以1 mol N2与4 mol H2混合充分反应,实际参加反应的N2物质的量小于1mol,则反应中转移的电子数目小于6 mol,A错误;
B. 反应2Mg(s)+CO2(g)= C(s)+2MgO(s)能自发进行,因为ΔS<0,所以该反应的ΔH<0,B错误;
C. 向0.1 mol·L1 CH3COONa溶液中加入少量水,溶液中c(CH3COO-)、c(OH-)减小,c(H+)增大,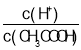 增大,C错误;
增大,C错误;
D. 在稀溶液中:H+(aq)+OH-(aq)= H2O(l) ΔH= -57.3kJ·mol1,若将含0.5 mol H2SO4的浓硫酸与1 L 1.0 mol·L1 的NaOH溶液混合,因为浓硫酸溶解放热,放出的热量为溶解热与中和热之和,所以放出的热量大于57.3 kJ,D正确。
故选D。

练习册系列答案
相关题目