题目内容
【题目】120℃、101.3 kPa,甲烷(CH4)和过量的O2的混合物,用电火花引燃(CH4+2O2=CO2+2H2O)后,恢复到原来的温度和压强,测得反应后气体密度为相同条件下H2密度的15倍,则原混合气体中甲烷和氧气的体积比为( )
A. 2∶1B. 1∶2C. 1∶7D. 7∶1
【答案】C
【解析】
120℃时燃烧生成的水为气态,氧气过量时发生反应:CH4+2O2=CO2+2H2O,由方程式可知反应前后气体的物质的量不变,则平均相对分子质量不变,反应后气体密度为相同条件下H2密度的15倍,则原混合气体中甲烷和氧气的平均相对分子质量为15×2=30,根据十字交叉法:
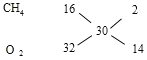
故原混合气体中甲烷和氧气的体积比为2:14=1:7。
答案选C。

练习册系列答案
相关题目





