题目内容
18.下列哪一组元素的原子间反应容易形成离子键( )| 原子 | a | b | c | d | e | f | g |
| M层电子数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| A. | a和c | B. | c和g | C. | e和g | D. | b和g |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,碱金属、碱土金属和第VIA族、第VIIA族元素之间易形成离子键,据此分析解答.
解答 解:活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,碱金属、碱土金属和第VIA族、第VIIA族元素之间易形成离子键,根据元素M电子层电子数知,a、b、c、d、e、f、g元素分别是Na、Mg、Al、Si、P、S、Cl元素,所以易形成离子键的是Na、Mg和S或Cl元素,故选D.
点评 本题考查离子键判断,明确离子键概念及物质构成微粒即可解答,注意含有金属元素的物质中不一定含有离子键,如氯化铝,题目难度不大.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
7.下列微粒中,未成对电子数最多的是( )
| A. | 氮原子 | B. | 氧原子 | C. | 铁离子 | D. | 铬原子 |
6.下面是同周期元素原子的价电子排布式,第一电离能最小的原子可能是( )
| A. | ns2np3 | B. | ns2np5 | C. | ns2np4 | D. | ns2np6 |
13.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 在标准状况下,2.24 L苯含有的分子数为0.1NA | |
| B. | 100ml 1mol/L的NH4Cl溶液中,NH4+的数目为0.1NA | |
| C. | 7.8 g Na2S和Na2O2的混合物中所含离子数为0.3NA | |
| D. | 电解精炼铜时,阳极质量每减少32 g,电路中就转移NA个电子 |
3.实验室可用如图所示装置制取的气体是( )
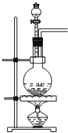

| A. | Cl2 | B. | C2H4 | C. | C2H2 | D. | CO2 |
8.从①P和S②Mg和Ca③Al和Si三组原子中,分别找出第一电离能较大的原子,将这3种原子的原子序数想家,其和是( )
| A. | 40 | B. | 41 | C. | 42 | D. | 48 |
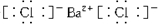 ,③的电子式是
,③的电子式是 .
.