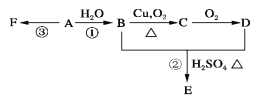
题目内容
【题目】氨气常用作致冷剂及制取铵盐和氮肥,是一种用途广泛的化工原料。
(1)下表是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。
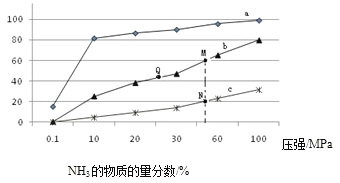
①曲线a对应的温度是 。
②关于工业合成氨的反应,下列叙述正确的是 (填字母)。
A. 及时分离出NH3可以提高H2的平衡转化率
B. 加催化剂能加快反应速率且提高H2的平衡转化率
C. 上图中M、N、Q点平衡常数K的大小关系是K(M)= K(Q) >K(N)
③ M点对应的H2转化率是 。
(2)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气。
① 当氨水中所含氨的物质的量为3 mol ,吸收标准状况下44.8 L SO2时,溶液中的溶质为 。
② NH4HSO3溶液显酸性。用氨水吸收SO2,当吸收液显中性时,溶液中离子浓度关系正确的是 (填字母)。
a.c(NH4+) = 2c(SO32-) + c(HSO3-)
b.c(NH4+)> c(SO32-)> c(H+)= c(OH-)
c.c(NH4+)+ c(H+)= c(SO32-)+c(HSO3-)+c(OH-)
(3)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理:
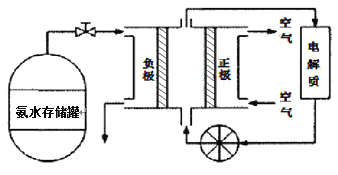
①氨气燃料电池的电解质溶液最好选择 (填“酸性”、“碱性”或“中性”)溶液。
②空气在进入电池装置前需要通过过滤器除去的气体是 。
③氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池正极的电极反应方是 。
【答案】(1)① 200℃ ② AC ③ 75%
(2)① (NH4)2SO3和NH4HSO3② a b
(3)① 碱性 ② CO2 ③ 3O2 + 12e-+ 6H2O = 12OH-或 O2 + 4e-+ 2H2O = 4OH-
【解析】
试题分析:(1)①合成氨反应放热,降低温度,平衡正向移动,氨的百分含量升高,即温度越低氨气的百分含量越高,所以,曲线a对应的温度是200℃;②A、减小生成物浓度平衡正向移动,及时分离出NH3可以提高H2的平衡转化率,正确;B、催化剂不影响平衡移动,加催化剂能加快反应速率但不能提高H2的平衡转化率,错误;C、K只受温度影响,该反应温度升高时K值减小,b是400℃,c是600℃,上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N),正确,选AC。
③ 3N2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g)
反应前(mol) 1 3 0
反应了(mol) x 3x 2x
平衡时(mol) 1-x 3-3x 2x
据题意M点时:2x/(4-2x)=60%,则x=3/4,则氢气的转化率为75%。
(2)①氨的物质的量为3mol,吸收标准状况下44.8L SO2时.N原子3mol,S原子2mol,据原子守恒,在(NH4)2SO3中,其原子个数比N:S=2:1,在中,NH4HSO3,其原子个数比N:S=1:1,所以,生成物有(NH4)2SO3和NH4HSO3。②据电荷守恒有:c(NH4+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),溶液显中性,则,c(H+)=c(OH-),故a、b正确,c错误,选:ab。
(3)①氨气是碱性气体,所以电解液最好选择碱性的;②空气中的CO2能和氨水反应,所以滤去的气体是CO2;③正极发生氧化反应,氧气在正极反应,注意时碱性环境,所以,正极的电极反应式为:O2+4e-+2H2O=4OH-。

 期末宝典单元检测分类复习卷系列答案
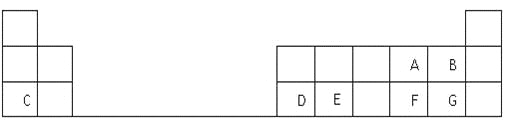
期末宝典单元检测分类复习卷系列答案【题目】C、N、O、Al、Si 、Cl、Fe是七种常见元素
(1)N元素位于周期表第 周期,第 族。
(2)用“>”、“<”或“= ”填空:
离子半径 | 得电子能力 | 酸性 | 金属性 |
O2― Al3+ | 16O 18O | H2CO3 HNO3 | Fe Al |
(3)SiO2及硅酸盐在自然界广泛存在,在日常生活、生产、科研及新型材料等方面有着重要的用途。高岭土[Al2(Si2O5)(OH)4]改写成氧化物的形式为 。
(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并用单线桥标出电子转移的方向和数目: 。
(5)将铝片(表面除去氧化膜)与碳棒用导线连接后插入稀NaOH溶液中可以构成原电池,电池正极为 ,电池负极反应的电极方程式为 。