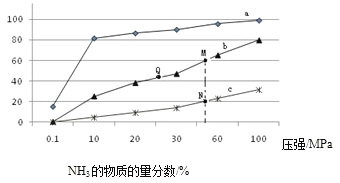
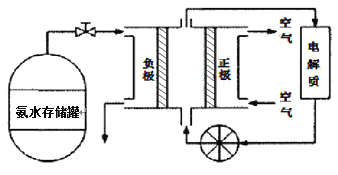
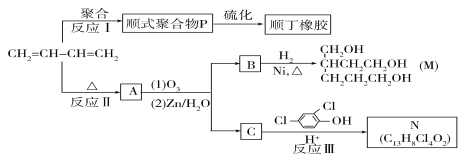
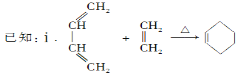题目内容
【题目】实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题:
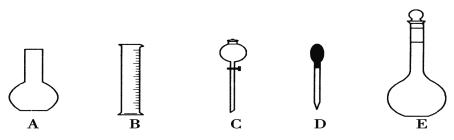
(1)如图所示的仪器中配制溶液肯定不需要的是①______________(填序号),配制上述溶液还需用到的玻璃仪器是②____________(填仪器名称)。
(2)根据计算用托盘天平称取NaOH的质量为③________g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度④__________0.1 mol·L-1(填“大于”、“等于”或“小于”)。
(3)由计算知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为⑤________mL(计算结果保留一位小数)。如果实验室有15 mL、20 mL、50 mL量筒,应选用⑥________mL量筒最好。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是将浓硫酸沿烧杯壁缓缓倒入水中,并用玻璃棒不断搅拌。
【答案】(1)①A、C;②烧杯、玻璃棒;(2)③2.0 ;④小于;(3)⑤13.6; ⑥15。
【解析】
试题分析:(1)配制溶液需要的仪器是托盘天平(量筒)、烧杯、玻璃棒、500mL容量瓶、胶头滴管,因此不需要的仪器是烧瓶、分液漏斗,即AC正确;缺少的仪器是玻璃棒、烧杯;(2)因为实验室没有450mL容量瓶,需要用500mL容量瓶,因此m(NaOH)=500×10-3×0.1×40g=2.0g;仰视读数,所配溶液的体积增大,浓度偏小,因此所配溶液浓度小于0.1mol·L-1;(3)稀释溶液溶质的质量或物质的量不变,因此有500×10-3×0.5=V×1.84×98%/98,V=13.6mL,量筒粗量仪器,应选择大而接近的,因此选15mL量筒。