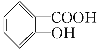
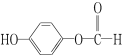
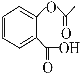
题目内容
【题目】C、N、O、Al、Si 、Cl、Fe是七种常见元素
(1)N元素位于周期表第 周期,第 族。
(2)用“>”、“<”或“= ”填空:
离子半径 | 得电子能力 | 酸性 | 金属性 |
O2― Al3+ | 16O 18O | H2CO3 HNO3 | Fe Al |
(3)SiO2及硅酸盐在自然界广泛存在,在日常生活、生产、科研及新型材料等方面有着重要的用途。高岭土[Al2(Si2O5)(OH)4]改写成氧化物的形式为 。
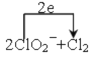
(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并用单线桥标出电子转移的方向和数目: 。
(5)将铝片(表面除去氧化膜)与碳棒用导线连接后插入稀NaOH溶液中可以构成原电池,电池正极为 ,电池负极反应的电极方程式为 。
【答案】(1)二、ⅤA (2)>、=、<、< (3)Al2O3·2SiO2·2H2O
(4)
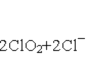 (5)碳棒 Al-3e—+4OH—=AlO2—+2H2O
(5)碳棒 Al-3e—+4OH—=AlO2—+2H2O
【解析】试题分析:(1)N原子核外有7个电子,分为2层,最外层5个电子,则N元素位于周期表第二周期,第ⅤA族。
(2)氧离子和铝离子的核外电子排布相同,铝的核电荷数大,则离子半径:O2―>Al3+;同一元素的不同核素,最外层电子数相同,化学性质相同,得电子能力:16O=18O;非金属性:C<N,非金属性越强,最高价含氧酸的酸性越强,则酸性:H2CO3< HNO3;铝比铁活泼,则金属性:Fe<Al。
(3)硅酸盐改写成氧化物形式的一般原则是:活泼金属氧化物不活泼金属氧化物非金属氧化物SiO2H2O,则高岭土[Al2(Si2O5)(OH)4]改写成氧化物的形式为Al2O3·2SiO2·2H2O。
(4)Cl2氧化NaClO2溶液制取ClO2,根据“价态归中”原则,ClO2-中Cl元素的化合价由+3价失电子生成ClO2中的+4价Cl,所以用线桥标出电子转移的方向和数目为![]() 。
。
(5)铝、C和氢氧化钠溶液构成的原电池,反应原理为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,铝失电子作原电池的负极,则正极为碳棒,电池负极反应的电极方程式为Al-3e—+4OH—=AlO2—+2H2O。