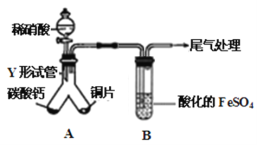
题目内容
【题目】石油裂解可获得A。已知A在通常状况下是一种相对分子量为28的气体,A通过加聚反应可以得到F,F常作为食品包装袋的材料。有机物A、B、C、D、E、F有如下图的关系。
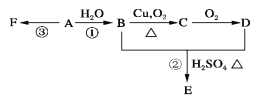
(1)A的分子式为________________。
(2)写出:反应①的化学方程式: ;该反应的类型是_______________。反应③的化学方程式:_____________________________________。
(3)G是E的同分异构体,且G能与NaHCO3反应,则G的可能结构简式分别为:
____________________________________________________________
(4)标况下,将A与某烃混合共11.2 L,该混合烃在足量的氧气中燃烧,生成CO2体积为17.92 L,生成H2O 18.0 g,则该烃的结构式为_____________;A与该烃的体积比为_____________。
【答案】(1)C2H4 (1分);
(2)CH2=CH2+H2O![]() CH3CH2OH(1分);加成反应(1分);
CH3CH2OH(1分);加成反应(1分);
nCH2=CH2→![]() (2分);
(2分);
(3)CH3CH2CH2COOH、(CH3)2CHCOOH(各1分);
(4)![]() (1分); 3∶2(2分);
(1分); 3∶2(2分);
【解析】
试题分析:石油裂解可获得A,A在通常状况下是一种相对分子量为28的气体,则A为CH2=CH2,A发生加聚反应生成F为![]() ,A与水发生加成反应生成B为CH3CH2OH,乙醇在Cu作催化剂条件下发生氧化反应生成C为CH3CHO,C进一步氧化生成D为CH3COOH,CH3CH2OH和CH3COOH在浓硫酸作用下反应生成E为CH3COOCH2CH3,
,A与水发生加成反应生成B为CH3CH2OH,乙醇在Cu作催化剂条件下发生氧化反应生成C为CH3CHO,C进一步氧化生成D为CH3COOH,CH3CH2OH和CH3COOH在浓硫酸作用下反应生成E为CH3COOCH2CH3,
(1)由上述分析可知,A为乙烯,分子式为C2H4,故答案为:C2H4;
(2)反应①是乙烯与水发生加成反应生成乙醇,反应化学方程式为:CH2=CH2+H2O ![]() CH3CH2OH,反应③是乙烯发生加聚反应生成聚乙烯,反应化学方程式为:nCH2=CH2
CH3CH2OH,反应③是乙烯发生加聚反应生成聚乙烯,反应化学方程式为:nCH2=CH2![]()
![]() ;(3)G是E(CH3COOCH2CH3)的同分异构体,且G能与NaHCO3反应,含有羧基,则G的可能结构简式分别为:CH3CH2CH2COOH、(CH3)2CHCOOH,故答案为:CH3CH2CH2COOH、(CH3)2CHCOOH;
;(3)G是E(CH3COOCH2CH3)的同分异构体,且G能与NaHCO3反应,含有羧基,则G的可能结构简式分别为:CH3CH2CH2COOH、(CH3)2CHCOOH,故答案为:CH3CH2CH2COOH、(CH3)2CHCOOH;
(4)标况下,将乙烯与某烃混合共11.2L,物质的量为11.2/22.4=0.5mol,燃烧生成CO2体积为17.92L,物质的量为17.92/22.4=0.8mol,生成H2O 18.0g,其物质的量为18/18=1mol,故平均分子式为C1.6H4,故另外的烃为甲烷,结构式为![]() ,令乙烯与甲烷的物质的量分别为xmol、ymol,则:(2x+y):(x+y)=1.6,整理得x:y=3:2,相同条件下,气体体积之比等于物质的量之比,故乙烯与甲烷的体积之比为3:2,故答案为:
,令乙烯与甲烷的物质的量分别为xmol、ymol,则:(2x+y):(x+y)=1.6,整理得x:y=3:2,相同条件下,气体体积之比等于物质的量之比,故乙烯与甲烷的体积之比为3:2,故答案为:![]() ;3:2.
;3:2.

【题目】向有机物X中加入合适的试剂(可以加热),检验其官能团。下列有关结论不正确的是:( )
选项 | 试剂 | 现象 | 结论 |
A | 金属钠 | 有气体产生 | 含羟基 或羧基 或羟基和羧基 |
B | 银氨溶液 | 产生银镜 | 含有醛基 |
C | 碳酸氢钠溶液 | 产生气泡 | 含有羧基 |
D | 溴水 | 溶液褪色 | 含有碳碳双键 |