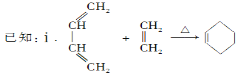��Ŀ����
����Ŀ���±���Ԫ�����ڱ���һ���֣����е�ÿ����ĸ��ʾһ�ֶ�����Ԫ��,�ش��������⣺
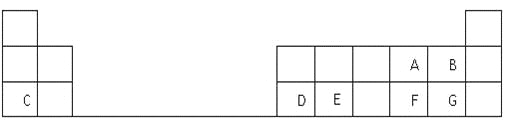
��1��G��Ԫ�����ڱ��е�λ���� ��
��2��A��B��C����Ԫ�صļ����Ӱ뾶�ɴ�С��˳��Ϊ �������ӷ��ű�ʾ����
��3��д��C��F����Ԫ���γɵĻ�����ĵ���ʽ ��
��4��Ԫ��E�ǹ��ɵؿǵ���ҪԪ��֮һ�������������ƹ��ά�Ļ���ԭ�ϣ����������к��еĻ�ѧ���� �������������������������������� ���壨������ͣ���д������������CԪ�����������ˮ���ﷴӦ�����ӷ���ʽ ��
��5��C���ӵ������Ա�D���ӵ������� ��������ǿ����������������ԭ���� ��
���𰸡���1����������, VIIA��
��2��O2-F-Na+
��3��![]()
��4������ ԭ�� SiO2 +2OH-= SiO32-+ H2O
��5���� Naԭ�ӱ�Alԭ����ʧ���ӣ�����Na+��Al3+�ѵõ��ӣ��������ɾ��÷֣�
�����������������AΪ����BΪ����CΪ�ƣ�DΪ����EΪ�裬FΪ��GΪ�ȡ���1����Ԫ���ڵ�������, VIIA�塣��2�������ӣ������Ӻ������ӵ��Ӳ�ṹ��ͬ���˵����Խ�뾶ԽС�����뾶˳��Ϊ��O2-��F-��Na+�� ��3���ƺ����γ����ƣ�����ʽΪ��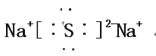 ����4���������躬�й��ۼ�������ԭ�Ӿ��壬����������������Ʒ�Ӧ���ɹ����ƺ�ˮ�����ӷ���ʽΪ��SiO2 +2OH-= SiO32-+ H2O����5��Naԭ�ӱ�Alԭ����ʧ���ӣ�����Na+��Al3+�ѵõ��ӣ����������ӵ������Ա������ӵ�����������
����4���������躬�й��ۼ�������ԭ�Ӿ��壬����������������Ʒ�Ӧ���ɹ����ƺ�ˮ�����ӷ���ʽΪ��SiO2 +2OH-= SiO32-+ H2O����5��Naԭ�ӱ�Alԭ����ʧ���ӣ�����Na+��Al3+�ѵõ��ӣ����������ӵ������Ա������ӵ�����������

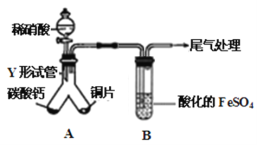
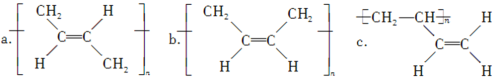
����Ŀ�����л���X�м�����ʵ��Լ�(���Լ���)������������š������йؽ��۲���ȷ�������� ��
ѡ�� | �Լ� | ���� | ���� |
A | ������ | ��������� | ���ǻ� ���Ȼ� ���ǻ����Ȼ� |
B | ������Һ | �������� | ����ȩ�� |
C | ̼��������Һ | �������� | �����Ȼ� |
D | ��ˮ | ��Һ��ɫ | ����̼̼˫�� |