题目内容
3.现有100mL混合溶液,其中含FeI2、FeBr2各0.1mol,向其中逐渐通入Cl2(假定Cl2分子只与溶质离子反应),已知:①一种氧化剂遇到多种还原剂时优先与还原性强的物质反应.②还原性:I->Fe2+>Br-,回答下列问题:(1)写出依次发生的离子反应Cl2+2I-=2Cl-+I2、Cl2+2Fe2+=2Fe3++2Cl-、Cl2+2Br-=2Cl-+Br2.
(2)当溶液中3种离子恰好全部被氧化时,共消耗Cl2的物质的量为0.3mol,此时溶液中的Fe3+物质的量浓度为2mol/L,Cl-的物质的量浓度是6mol/L
(3)当溶液中的离子全部被氧化时,向该溶液中加入足量的NaOH溶液,得到的固体化学式是Fe(OH)3,分此混合物的方法是过滤(填操作名称)将分离出的固体经洗涤、干燥、灼烧至质量不再改变得到固体的质量是16g.
分析 (1)还原能力强弱顺序为I->Fe2+>Br-,则逐滴滴入氯水,则先后发生:Cl2+2I-=2Cl-+I2、Cl2+2Fe2+=2Fe3++2Cl-、Cl2+2Br-=2Cl-+Br2;
(2)根据离子方程式计算;溶液最终生成FeCl3,根据三价铁离子的物质的量求出浓度,根据Cl守恒计算氯离子的浓度;
(3)FeCl3溶液中加NaOH生成氢氧化铁沉淀,过滤得到氢氧化铁固体,将分离出的固体经洗涤、干燥、灼烧得到氧化铁,根据铁元素守恒计算氧化铁的质量.
解答 解:(1)还原能力强弱顺序为I->Fe2+>Br-,氯气先与还原性强的反应,则逐滴滴入氯水,发生:Cl2+2I-=2Cl-+I2、Cl2+2Fe2+=2Fe3++2Cl-、Cl2+2Br-=2Cl-+Br2;
故答案为:Cl2+2I-=2Cl-+I2、Cl2+2Fe2+=2Fe3++2Cl-、Cl2+2Br-=2Cl-+Br2;
(2)含FeI2、FeBr2各0.1mol,则I-为0.2mol、Br-为0.2mol、Fe2+为0.2mol,根据离子方程式可知消耗的氯气为n(Cl2)=0.3mol;溶液最终生成FeCl3,则溶液中的Fe3+物质的量浓度为$\frac{0.2mol}{0.1L}$=2mol/L,根据根据Cl守恒计算氯离子的浓度c(Cl-)=3c(Fe3+)=6mol/L;
故答案为:0.3mol;2mol/L;6mol/L;
(3)FeCl3溶液中加NaOH生成氢氧化铁沉淀,其反应方程式为:FeCl3+3NaOH=3NaCl+Fe(OH)3↓,分离固液混合物采用过滤操作,过滤得到氢氧化铁固体,将分离出的固体经洗涤、干燥、灼烧得到氧化铁,n(Fe2O3)=$\frac{1}{2}$n(Fe3+)=0.1mol,所以m(Fe2O3)=nM=0.1mol×160g/mol=16g;
故答案为:Fe(OH)3;过滤;16.
点评 本题考查物质的性质以及方程式的计算,注意根据离子的还原性判断反应的先后顺序,为解答该题的关键,注意结合反应的离子方程式解答该题,难度中等.

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案| A. | 热稳定性:纯碱>石灰石>小苏打>碳酸 | |
| B. | 除Li外其它碱金属单质均可以保存在煤油中 | |
| C. | 碱金属都是活泼的金属元素,其盐都不发生水解 | |
| D. | 最高氧化物对应水化物碱性LiOH<NaOH<KOH<RbOH<CsOH |
(1)2H2(气)+O2(气)═2H2O(气)+Q1
(2)2H2(气)+O2(气)═2H2O(液)+Q2
(3)H2(气)+O2(气)═H2O(气)+Q3.
| A. | Q1>Q2,Q2=2Q3 | B. | Q1=Q2=Q3 | C. | Q1<Q2,Q3=$\frac{{Q}_{1}}{2}$ | D. | 无法比较 |
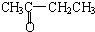 B.
B.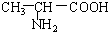 与
与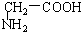
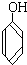 与
与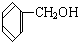 D.CH3CH2C≡CH与CH2=CH-CH=CH2
D.CH3CH2C≡CH与CH2=CH-CH=CH2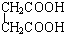 与
与  F.戊烯和环戊烷
F.戊烯和环戊烷
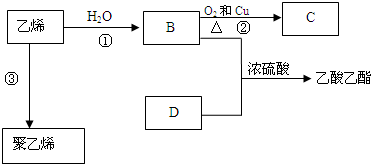
 .
. 反应类型:加聚反应
反应类型:加聚反应

 用如图所示装置进行实验,将液体A逐滴加入到固体B中,回答下列问题:
用如图所示装置进行实验,将液体A逐滴加入到固体B中,回答下列问题: