题目内容
18.(1)配平该反应并标出电子转移的方向和数目:2KMnO4+16HCl═2MnCl2+2KCl+5Cl2↑+8H2O
(2)氧化剂是KMnO4,氧化产物是Cl2(填化学式).
(3)若生成71g Cl2消耗的HCl是3.2mol,被氧化的HCl是2mol.
分析 (1)在该反应中锰从+7价降为+2价,氯从-1价升为0价,根据化合价升降法可结构观察法可配平;
(2)在氧化还原反应中,有元素化合价降低的物质为氧化剂,元素化合价升高后得到的产物为氧化产物;
(3)根据化学方程式计算消耗的HCl,根据氧化还原反应的有关概念可知,被氧化的HCl即化合价升高的部分HCl,据此进行计算.
解答 解:(1)在该反应中锰从+7价降为+2价,氯从-1价升为0价,在氧化还原反应元素化合价升高的总数与降低的总数应相等,结合质量守恒可知,该反应的方程式为2KMnO4+16HCl═2MnCl2+2KCl+5Cl2↑+8H2O,
故答案为:2、16、2、2、5、8;
(2)在反应2KMnO4+16HCl═2MnCl2+2KCl+5Cl2↑+8H2O中,KMnO4中锰元素化合价从+7价降为+2价,所以KMnO4是氧化剂,盐酸中的氯元素化合价升高后得到的产物Cl2,所以Cl2为氧化产物,
故答案为:KMnO4;Cl2;
(3)71g Cl2即1molCl2,根据化学方程式2KMnO4+16HCl═2MnCl2+2KCl+5Cl2↑+8H2O可知,生成1molCl2消耗的HCl3.2mol,其中有2molHCl被氧化成氯气,
故答案为:3.2;2.
点评 本题考查学生氧化还原反应中的有关概念和计算,要求学生要熟练掌握基础知识,并具有一定分析和解决问题的能力,难度中等.

练习册系列答案
相关题目
6.向氯化铁溶液中加入过量氢氧化钠溶液,振荡后静置一段时间,下列关于该体系的说法中,不正确的是( )
| A. | 生成了氢氧化铁沉淀 | |
| B. | 体系中存在着氢氧化铁的沉淀溶解平衡 | |
| C. | 溶液中不再存在Fe3+ | |
| D. | 加入少量盐酸,则溶液中Fe3+浓度会上升 |
13.下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是Ar,只有负价而无正价的元素是F,可用于制半导体材料的元素是Si
(2)C元素在元素周期表中的位置是三周期ⅢA族.
(3)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3;
(4)A分别与E、G、H形成的化合物中,最稳定的HF;
(5)在B、C、E、F中,原子半径最大的是Na.
(6)写出B与C两种元素的最高价氧化物对应的水化物相互反应的化学方程式Al(OH)3+NaOH=NaAlO2+2H2O.
(7)B、H两种元素形成的化合物所含的化学键类型为离子键
(8)写出C的最高价氧化物与H的氢化物之间反应的离子方程式Al2O3++6H+=2Al3++3H2O.
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
(2)C元素在元素周期表中的位置是三周期ⅢA族.
(3)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3;
(4)A分别与E、G、H形成的化合物中,最稳定的HF;
(5)在B、C、E、F中,原子半径最大的是Na.
(6)写出B与C两种元素的最高价氧化物对应的水化物相互反应的化学方程式Al(OH)3+NaOH=NaAlO2+2H2O.
(7)B、H两种元素形成的化合物所含的化学键类型为离子键
(8)写出C的最高价氧化物与H的氢化物之间反应的离子方程式Al2O3++6H+=2Al3++3H2O.
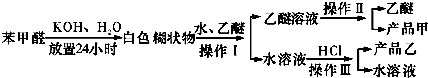
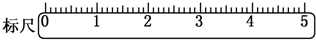 实验课上配制500mL 0.5mol/L的NaOH溶液,试回答下列问题.
实验课上配制500mL 0.5mol/L的NaOH溶液,试回答下列问题.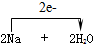 =2NaOH+H2↑.
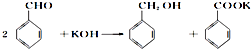
=2NaOH+H2↑.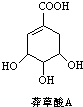 为原料的有机合成路线:
为原料的有机合成路线: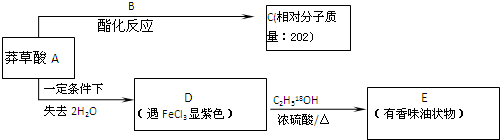
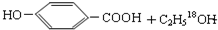 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$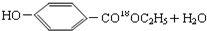 .
.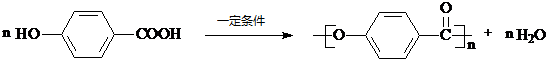 .
.