题目内容
4.在某温度下,向一恒容密闭容器中加入一定量NH4I固体,发生如下两个反应:NH4I(s)?NH3(g)+HI(g) 平衡常数K1; 2HI(g)?H2(g)+I2(g)平衡常数K2,平衡时测得容器中c(H2)=1mol/L,c(HI)=2mol/L.下列说法正确的是( )| A. | K1=16 | B. | K1=8 | C. | K2=1 | D. | K2=0.5 |
分析 NH4I分解出的HI为平衡与已分解的之和,即为NH4I分解出的NH3物质的量浓度,I2来自HI的分解,根据H2为1mol/L可知,HI分解的浓度,进而计算NH3的浓度,根据数据计算化学平衡常数.
解答 解:反应达到平衡时c(H2)=1mol/L,根据2HI(气)?H2(气)+I2(气)可知,HI分解的浓度为2×1mol/L=2mol/L,反应达到平衡时c(HI)=2mol/L,所以NH4I分解平衡时生成c(HI)=2mol/L+2mol/L=4mol/L,所以平衡时NH3的浓度 c(NH3)=4mol/L,所以K1=c(NH3)•c(HI)=2×4=8,K2=$\frac{1×1}{2}$=0.5,故选B.
点评 本题考查化学平衡的计算,解题关键在于明白NH4I分解出的HI为平衡与已分解的之和.

练习册系列答案
相关题目
15.容量瓶上标有的是:①温度、②浓度、③容量、④质量、⑤刻度线、⑥密度,其中正确的是( )
| A. | ①③⑤ | B. | ③⑤⑥ | C. | ①⑤⑥ | D. | ②③⑤ |
12.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按右式进行:Cd+2NiOOH+2H2O$\frac{\underline{\;充电\;}}{放电}$Cd(OH)2+2Ni(OH)2 由此可知,该电池充电时在阴极上发生反应的是( )
| A. | Ni(OH)2 | B. | Cd(OH)2 | C. | Cd | D. | NiOOH |
19.近代化学中,把化学元素及其化合物纳入一个统一的理论体系的标志是( )
| A. | 1869年俄国科学家门捷列夫发现元素周期律 | |
| B. | 1803年英国科学家道尔顿建立原子学说 | |
| C. | 1771年法国科学家拉瓦锡建立氧化学说 | |
| D. | 1661年英国科学家波义耳提出了化学元素的概念 |
9.在标准状况下进行下列实验:甲、乙、丙各取30.00ml同浓度的盐酸,加入同一镁铝合金,产生气体,测得有关数据列表如表:
(1)分析表格数据后填空:
①盐酸的物质的量浓度为1 mol•L-1.
②据甲(填实验序号)中的数据,可计算出合金中镁与铝的物质的量分别为0.005mol;0.005mol.
(2)在丙实验之后,向容器中加入一定量1.00mol•L-1的NaOH溶液,使合金中的铝恰好完全溶解,再滤出不溶固体.请计算:
①滤液中的溶质及其物质的量是NaCl为0.03mol,NaAlO2为0.009mol.
②加入NaOH溶液的体积为39mL.
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量 | 0.255g | 0.385g | 0.459g |
| 气体体积 | 280mL | 336mL | 336mL |
①盐酸的物质的量浓度为1 mol•L-1.
②据甲(填实验序号)中的数据,可计算出合金中镁与铝的物质的量分别为0.005mol;0.005mol.
(2)在丙实验之后,向容器中加入一定量1.00mol•L-1的NaOH溶液,使合金中的铝恰好完全溶解,再滤出不溶固体.请计算:
①滤液中的溶质及其物质的量是NaCl为0.03mol,NaAlO2为0.009mol.
②加入NaOH溶液的体积为39mL.
13.用NA表示阿伏加德罗常数的值.下列说法中正确的是( )
| A. | 2.4g金属镁变成镁离子时失去的电子数为0.1NA | |
| B. | 标准状况下,11.2LCCl4所含的分子数为0.5NA | |
| C. | 0.5mol/LAlCl3溶液中Cl-的数目为2NA | |
| D. | 17g氨气中含有的电子数为10NA |
14.下列各组离子一定能大量共存的是( )
| A. | 25℃,由水电离出的c(H+)=10-11mol/L的溶液:Na+、K+、Cl-、ClO- | |
| B. | 与Al反应能放出氢气的溶液:Na+、Ba2+、NO3-、Cl- | |
| C. | 甲基橙变红的溶液:Na+、Mg2+、SO42-、Cl- | |
| D. | 含Al3+的溶液:K+、Ca2+、Cl-、S2- |
 .
.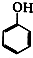 +NaOH→
+NaOH→ +H2O.
+H2O. .
. $\stackrel{酸性KMnO_{4}溶液}{→}$CO2.
$\stackrel{酸性KMnO_{4}溶液}{→}$CO2.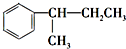 $\stackrel{酸性KMnO_{4}溶液}{→}$
$\stackrel{酸性KMnO_{4}溶液}{→}$ .
.