题目内容
13.用NA表示阿伏加德罗常数的值.下列说法中正确的是( )| A. | 2.4g金属镁变成镁离子时失去的电子数为0.1NA | |
| B. | 标准状况下,11.2LCCl4所含的分子数为0.5NA | |
| C. | 0.5mol/LAlCl3溶液中Cl-的数目为2NA | |
| D. | 17g氨气中含有的电子数为10NA |
分析 A、求出镁的物质的量,然后根据反应后镁元素为+2价来分析;
B、标况下,四氯化碳为液态;
C、溶液体积不明确;
D、求出氨气的物质的量,然后根据氨气为10电子分子来分析.
解答 解:A、2.4g镁的物质的量为0.1mol,而反应后镁元素为+2价,故0.1mol镁失去0.2mol电子即0.2NA个,故A错误;
B、标况下,四氯化碳为液态,不能根据气体摩尔体积来计算其物质的量,故B错误;
C、溶液体积不明确,故溶液中的氯离子的个数无法计算,故C错误;
D、17g氨气的物质的量为1mol,而氨气为10电子分子,故1mol氨气中含10mol电子即10NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
4.在某温度下,向一恒容密闭容器中加入一定量NH4I固体,发生如下两个反应:NH4I(s)?NH3(g)+HI(g) 平衡常数K1; 2HI(g)?H2(g)+I2(g)平衡常数K2,平衡时测得容器中c(H2)=1mol/L,c(HI)=2mol/L.下列说法正确的是( )
| A. | K1=16 | B. | K1=8 | C. | K2=1 | D. | K2=0.5 |
1.下列各组物质之间的化学反应,反应产物一定为纯净物的是( )
| A. |  → → | |
| B. | CH2═CH-CH2-CH3+HCl$→_{△}^{催化剂}$ | |
| C. | CH3-CH═CH2+H2O$→_{加热、加压}^{催化剂}$ | |
| D. | nCH2═CH2+nCH2═CH-CH3$→_{△}^{催化剂}$ |
8.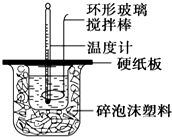 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
(1)本实验中用稍过量的NaOH的原因是保证盐酸完全被中和.在大小烧杯中填充泡沫塑料的作用是保温隔热,防止热量散失.
(2)该实验小组做了三次实验,每次取溶液各50mL,并记录下原始数据(见下表).
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容为:c=4.18×10-3kJ/(g•℃),则写出该反应的热化学方程式H+(aq)+OH-(aq)=H2O(l)△H=-56.0kJ/mol(△H值保留到小数点后1位).
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会比(2)测出的△H偏大(填“偏大”、“偏小”或“不变”),其原因是醋酸是弱酸,反应时需要吸收热量用于醋酸的电离,所以,测得的中和反应的反应热数值会偏小,该反应为放热反应,△H则偏大.
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸后再用温度计测定NaOH溶液温度的步骤,若无此操作步骤,则测得的中和热△H会偏大(填“偏大”、“偏小”或“不变”).
 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:(1)本实验中用稍过量的NaOH的原因是保证盐酸完全被中和.在大小烧杯中填充泡沫塑料的作用是保温隔热,防止热量散失.
(2)该实验小组做了三次实验,每次取溶液各50mL,并记录下原始数据(见下表).
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差 (t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会比(2)测出的△H偏大(填“偏大”、“偏小”或“不变”),其原因是醋酸是弱酸,反应时需要吸收热量用于醋酸的电离,所以,测得的中和反应的反应热数值会偏小,该反应为放热反应,△H则偏大.
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸后再用温度计测定NaOH溶液温度的步骤,若无此操作步骤,则测得的中和热△H会偏大(填“偏大”、“偏小”或“不变”).
18.在物质混合、反应等过程中,会存在“1+1≠2”的现象.通常情况下,下列各种混合或反应过程中,“1+1”不等于“2”的是( )
| A. | 1g酒精和1g水混合后的总质量 | |
| B. | 100mL酒精与100mL水混合均匀后所得溶液的总体积 | |
| C. | 温度一定时1gH2O溶解1g硝酸钾后,所得溶液的质量 | |
| D. | 1g氢氧化钠溶液和1g醋酸溶液混合后溶液的质量 |
5.在氢硫酸溶液中,通入或加入少量的下列物质:①O2;②Cl2;③SO2;④CuSO4;⑤NH3能使溶液的导电能力增强的是( )
| A. | ①②③ | B. | ②④⑤ | C. | ①④⑤ | D. | ②③④ |
3.设NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1mol甲基所含有的电子数为10NA | |
| B. | 标准状况下,11.2L氯仿(CHCl3)中含有C-Cl键的数目为1.5NA | |
| C. | 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2 NA | |
| D. | 6.0g冰醋酸与4.6g乙醇反应生成乙酸乙酯的分子数为0.1 NA |