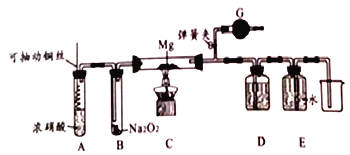
题目内容
【题目】25℃时,某浓度的碳酸中含碳微粒的物质的量浓度的对数值与溶液的pH的关系如下图所示。下列说法正确的是( )
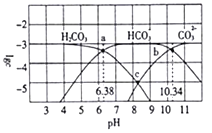
A. lgKa1(H2CO3)=6.38
B. C点对应溶液的pH=8.36
C. 溶液的pH=8时,c(HCO3-)>c(OH-)>c(CO32-)
D. 25℃时,反应CO32-+H2CO3=2HCO3-的平衡常数对数值1gK=-6.96
【答案】B
【解析】A、在a点处, ![]() ,溶液的pH=6.38,由Ka1=
,溶液的pH=6.38,由Ka1= 可知 Ka1=
可知 Ka1= ![]() ,lgKa1(H2CO3)=-6.38,同理lgKa2(H2CO3)=-10.34,选项A错误;B、在点c处,c(CO32-)=c(H2CO3),由Ka2=
,lgKa1(H2CO3)=-6.38,同理lgKa2(H2CO3)=-10.34,选项A错误;B、在点c处,c(CO32-)=c(H2CO3),由Ka2= 可知 Ka1·Ka2=
可知 Ka1·Ka2=![]() ,pH=
,pH=![]() ,选项B正确;C、溶液的pH=8时,c(HCO3-)>c(CO32-)>c(OH-),选项C错误;D、该反应的平衡常数
,选项B正确;C、溶液的pH=8时,c(HCO3-)>c(CO32-)>c(OH-),选项C错误;D、该反应的平衡常数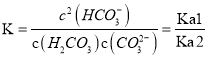 ,故lgK= lgKa1- lgKa2=-6.38-(-10.34)=3.96,选项D错误。答案选B。
,故lgK= lgKa1- lgKa2=-6.38-(-10.34)=3.96,选项D错误。答案选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目