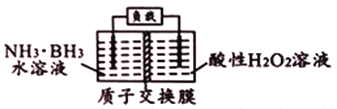
题目内容
【题目】当用酸滴定碱时,下列操作中使测定结果(碱的浓度)偏低的是( )
A. 酸式滴定管滴至终点后,俯视读数
B. 碱液移入锥形瓶后,加入了10mL蒸馏水再滴定
C. 酸式滴定管用蒸馏水润洗后,未用操作液洗
D. 酸式滴定管注入酸液后,尖嘴留有气泡,开始滴定
【答案】A
【解析】中和滴定的原理为氢离子与氢氧根的物质的量相等,则![]() ,标准液的浓度c(酸)一定,所取待测液的体积V(碱)一定,当V(酸)偏大,测定结果c(碱)偏大,当V(酸)偏小,测定结过c(碱)偏小。A、俯视读数,则读数偏小,即所记录的V(酸)比实际值偏小,则c(碱)偏低,故A正确;B、将锥形瓶中的碱液稀释,并没有改变OH-的物质的量,所以对测定结果无影响,故B错误;C、没有用标准液润洗酸式滴定管,则相当于稀释了酸,因此滴定过程中消耗酸的体积偏大,测定结果偏高,故C错误;D、尖嘴留有气泡,则说明所记录的酸的体积大于实际所消耗酸的体积,因此测定结果偏高,故D错误。故选A。
,标准液的浓度c(酸)一定,所取待测液的体积V(碱)一定,当V(酸)偏大,测定结果c(碱)偏大,当V(酸)偏小,测定结过c(碱)偏小。A、俯视读数,则读数偏小,即所记录的V(酸)比实际值偏小,则c(碱)偏低,故A正确;B、将锥形瓶中的碱液稀释,并没有改变OH-的物质的量,所以对测定结果无影响,故B错误;C、没有用标准液润洗酸式滴定管,则相当于稀释了酸,因此滴定过程中消耗酸的体积偏大,测定结果偏高,故C错误;D、尖嘴留有气泡,则说明所记录的酸的体积大于实际所消耗酸的体积,因此测定结果偏高,故D错误。故选A。

【题目】室溫下,0.25molC2H4(g)完全燃烧生成二氧化碳和液态水,放出352.75kJ的热量。请写出该反应的热化学方程式:_________________。为了缓解温空效应,科学家提出了多种回收和利用CO2的方案。
方案1: 利用FeO吸收CO2获得H2
ⅰ.6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ΔH1=-76.0kJ/mol
ⅱ.C(s)+2H2O(g)=CO2(g)+2H2(g) ΔH2 = + 113. 4kJ/mol
(1) 3FeO(g)+H2O(g)= Fe3O4(s)+H2(g) ΔH3 =__________
(2) 在反应i中,每放出38.0kJ热量有____________gFeO被氧化。
室温下,物质的量浓度均为0.lmol/L 的几种盐溶液的pH如下表:
序号 | ① | ② | ③ | ④ | ⑤ |
溶液 | NH4Cl | CH3COONH4 | NaHCO3 | NaX | Na2CO3 |
pH | 5 | 7 | 8.4 | 9.7 | 11.6 |
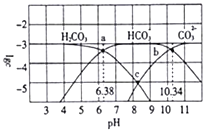
(3)写出溶液④中通入少量CO2的离子方程式:__________
(4)25℃时,溶液①中,由水电离产生的c(OH-)=_____mol/L。
(5)下列说法正确的是__________ (填序号)。
A.c(NH4+):①>②
B.物质的量浓度和体积均相等的NaCl和CH3COONH4两种溶液中,离子总数相等
C.等体积的③和⑤形成的混合溶液中:c(HCO3-)+c(CO32-)=0.1mol/L
D.将pH相同的CH3COOH和HX溶液加水稀释相同倍数,HX溶液的pH变化小
方案2:利用CO2制备CH4
300℃时,向2L恒容密闭容器中充入2molCO2和8molH2发生反应:CO2(g)+4H2(g)![]() CH4(g)+ 2H2O(g)ΔH4,混合气体中CH4的浓度与反应时间的关系如图所示。
CH4(g)+ 2H2O(g)ΔH4,混合气体中CH4的浓度与反应时间的关系如图所示。
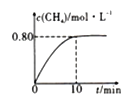
(6)①从反应开始到恰好达到平衡时,H的平均反应速率v(H2)=____________。
②300℃时,反应的平衡常数K=____________。
③保持温度不变,向平衡后的容器中再充入2molCO2和8molH2,重新达到平衡时CH4的浓度__(填序号)。
A.等于0.8mo/L B.等于1.6mo/L
C.0.8mol/L4)<1.6mol/L D.大于1.6mol/L
(7)300℃时,如果该容器中有1.6molCO2、2.0molH2、5.6molCH4、4.0molH2O(g).则v正___v逆
(填“>”“<”或“=" )。
(8)已知:200℃时,该反应的平衡常数K=64.8L2·mol-2。则ΔH4____0(填“>”“<”或“=”)。
方案3:利用“Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na-CO2”电池以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
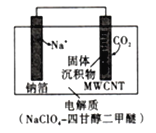
(9)①放电时,正极的电极反应式为____________。
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2mole-时,两极的质量差为___g。