题目内容
【题目】某课外活动小组探究NO2性质,其实验装置如下图所示(夹持和固定装置省去)
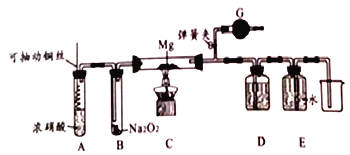
(1)铜与浓硝酸反应的离子方程式为__________,装置A的优点是______________。
(2)G中试剂为_________,作用是________________________。
(3)类比Mg与CO2反应的思路,写出Mg与NO2反应的化学方程式___________________,设计装置D(内装NaOH溶液)和装置E的目的是______________________。
(4)一段时间后,装置B中管壁发烫,瓶内红棕色物质消失,淡黄色粉末变成白色固体(为单一物质)。小组同学认为Na2O2与NO2发生了氧化还原反应,其结果有两种假设:
①NO2被Na2O2氧化,则白色固体是_______(填化学式)。
②NO2被Na2O2还原,为了验证此产物,取适量白色固体于试管中,加蒸馏水溶解,滴加酸性高锰酸钾溶液,则观察到的现象是__________________________。
【答案】 Cu+4H++2NO3-=Cu2++2NO2↑+2H2O 可以控制反应的速率 碱石灰(NaOH固体) 吸收NO2,避免污染环境 Mg+2NO2![]() 4MgO+N2 证明装置C中发生反应生成N2 NaNO3 高锰酸钾溶液褪色
4MgO+N2 证明装置C中发生反应生成N2 NaNO3 高锰酸钾溶液褪色
【解析】试题分析:(1)铜与浓硝酸反应生成硝酸铜、二氧化氮、水;铜丝可以抽动,能控制反应的速率;(2)NO2有毒,G中可以盛放氢氧化钠(或碱石灰)吸收NO2;(3)Mg与CO2反应生成氧化镁和碳, Mg与NO2反应生成氧化镁和氮气;装置D(内装NaOH溶液)可以吸收)NO2,氮气难溶于水,若装置E中收集到气体,该气体是N2;(4)①NO2被Na2O2氧化,则生成硝酸盐;②NO2被Na2O2还原,则生成亚硝酸盐,亚硝酸盐可以被高锰酸钾氧化;
解析:(1)铜与浓硝酸反应生成硝酸铜、二氧化氮、水,反应离子方程式是Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;通过抽动铜丝可以控制反应的速率;(2)NO2有毒,G中可以盛放氢氧化钠(或碱石灰)吸收NO2,避免污染环境;(3)Mg与NO2反应生成氧化镁和氮气,反应方程式是Mg+2NO2![]() 4MgO+N2;装置D(内装NaOH溶液)可以吸收)NO2,氮气难溶于水,若装置E中收集到气体,则证明装置C中发生反应生成N2;(4)①NO2被Na2O2氧化,则生成硝酸盐,白色固体是NaNO3;②NO2被Na2O2还原,则生成亚硝酸盐,亚硝酸盐可以被高锰酸钾氧化,所以高锰酸钾溶液褪色。
4MgO+N2;装置D(内装NaOH溶液)可以吸收)NO2,氮气难溶于水,若装置E中收集到气体,则证明装置C中发生反应生成N2;(4)①NO2被Na2O2氧化,则生成硝酸盐,白色固体是NaNO3;②NO2被Na2O2还原,则生成亚硝酸盐,亚硝酸盐可以被高锰酸钾氧化,所以高锰酸钾溶液褪色。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案