��Ŀ����
����Ŀ��
��ʯ�Ͳ�ƷA(C3H6)Ϊ��Ҫԭ�ϣ��ϳɾ��й㷺��;���л�����PMMA��������ͼ (���ֲ��������ʡ��) :

�Իش���������:
(1)A�ĽṹʽΪ__________����ͬһƽ�����ԭ�Ӹ���Ϊ________��X�Լ�����ʽΪ________��E�зǺ��������ŵ�����Ϊ________��
(2) E![]() G�Ļ�ѧ����ʽΪ______����Ӧ������___________��
G�Ļ�ѧ����ʽΪ______����Ӧ������___________��
(3) T��G��ͬ���칹�壬lmolT ����������Cu(OH)2����Һ��Ӧ�������2molCu2O��������д��T�����нṹ��ʽ: __________(��������ṹ)��
(4) ���߷��ӻ�����PMMA ����Է�������Ϊ1.5��106����ۺ϶�Ϊ_________.
(5) �����������̣��� Ϊԭ�Ϻϳ�
Ϊԭ�Ϻϳ� (����ԭ����ѡ)����ƺϳ�·��_________��
(����ԭ����ѡ)����ƺϳ�·��_________��
���𰸡� 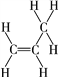 7
7 ![]() ̼̼˫��
̼̼˫�� ![]() ������Ӧ(��ȡ����Ӧ)
������Ӧ(��ȡ����Ӧ) ![]()
![]() 1.5��104
1.5��104 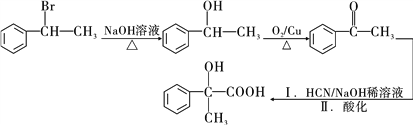
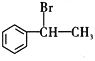
��������ͨ���л���B����ΪC��֪��BΪ2-������XΪˮ��ͨ���л���D��C�ṹ�仯��֪��C��HCN�����˼ӳɷ�Ӧ����Ϊ�ǻ����ͨ��������PMMA�ṹ��֪�����л�����ͨ��G�Ӿ۷�Ӧ���ɵģ�E ��FΪ����ͼ״�����������Ӧ��D ��EΪ��ȥ��Ӧ��
(1)AΪ��ϩ���ṹʽΪ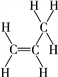 �������������1��̼��1����ԭ������ϩ����ƽ�棬�����ͬһƽ��ԭ�Ӹ������Ϊ7����X�Լ�Ϊˮ������ʽΪ
�������������1��̼��1����ԭ������ϩ����ƽ�棬�����ͬһƽ��ԭ�Ӹ������Ϊ7����X�Լ�Ϊˮ������ʽΪ![]() ���л���EΪ2-����ϩ�ᣬ���зǺ��������ŵ�����Ϊ̼̼˫������ȷ�𰸣�(1).
���л���EΪ2-����ϩ�ᣬ���зǺ��������ŵ�����Ϊ̼̼˫������ȷ�𰸣�(1).  �� 7��
�� 7�� ![]() ��̼̼˫����
��̼̼˫����
(2) 2-����ϩ����״���Ũ���������·���������Ӧ����Ӧ����ʽΪ��![]() ����ȷ�𰸣�
����ȷ�𰸣�![]() ��������Ӧ(��ȡ����Ӧ)
��������Ӧ(��ȡ����Ӧ)
��3��G�Ľṹ��ʽΪCH2=C(CH3)-COOCH3 , lmolT ����������Cu(OH)2����Һ��Ӧ�������2molCu2O������˵�����л����к���2��ȩ�������Է��ϸ��������л���ṹ��ʽΪ�� ![]() ����ȷ�𰸣�
����ȷ�𰸣� ![]() ��
��
(4) �л���PMMA�ķ���ʽΪ(C5H8O2)n���߷��ӻ��������Է�������Ϊ1.5��106, 100 n=1.5��106, n= 1.5��104,��ۺ϶�Ϊ1.5��104����ȷ�𰸣�1.5��104��
(5)  �ڼ��Ի����£�ˮ�������������ͭ���������������£�������Ϊ����ͪ������ͪ��HCN�ڼ��������·����ӳɷ�Ӧ�����ǻ����ᣬ��Ӧ���������£�
�ڼ��Ի����£�ˮ�������������ͭ���������������£�������Ϊ����ͪ������ͪ��HCN�ڼ��������·����ӳɷ�Ӧ�����ǻ����ᣬ��Ӧ���������£�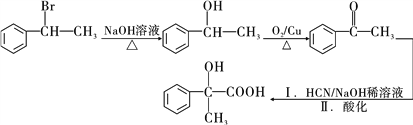 ����ȷ�𰸣�
����ȷ�𰸣� ��
��

 �ܿ�����ĩ��̾�ϵ�д�
�ܿ�����ĩ��̾�ϵ�д�����Ŀ���Ҝ��£�0.25molC2H4(g)��ȫȼ�����ɶ�����̼��Һ̬ˮ���ų�352.75kJ����������д���÷�Ӧ���Ȼ�ѧ����ʽ:_________________��Ϊ�˻����¿�ЧӦ����ѧ������˶��ֻ��պ�����CO2�ķ�����
����1: ����FeO����CO2���H2
��.6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ��H1=-76.0kJ/mol
��.C(s)+2H2O(g)=CO2(g)+2H2(g) ��H2 = + 113. 4kJ/mol
(1) 3FeO(g)+H2O(g)= Fe3O4(s)+H2(g) ��H3 =__________
(2) �ڷ�Ӧi�У�ÿ�ų�38.0kJ������____________gFeO��������
�����£����ʵ���Ũ�Ⱦ�Ϊ0.lmol/L �ļ�������Һ��pH���±�:
��� | �� | �� | �� | �� | �� |
��Һ | NH4Cl | CH3COONH4 | NaHCO3 | NaX | Na2CO3 |
pH | 5 | 7 | 8.4 | 9.7 | 11.6 |
(3)д����Һ����ͨ������CO2�����ӷ���ʽ:__________
(4)25��ʱ����Һ���У���ˮ���������c(OH-)=_____mol/L��
(5)����˵����ȷ����__________ (�����)��
A.c(NH4+):��>��
B.���ʵ���Ũ�Ⱥ��������ȵ�NaCl��CH3COONH4������Һ�У������������
C.������Ģۺ͢��γɵĻ����Һ��:c(HCO3-)+c(CO32-)=0.1mol/L
D.��pH��ͬ��CH3COOH��HX��Һ��ˮϡ����ͬ������HX��Һ��pH�仯С
����2:����CO2�Ʊ�CH4
300��ʱ����2L�����ܱ������г���2molCO2��8molH2������Ӧ:CO2(g)+4H2(g)![]() CH4(g)+ 2H2O(g)��H4,���������CH4��Ũ���뷴Ӧʱ��Ĺ�ϵ��ͼ��ʾ��
CH4(g)+ 2H2O(g)��H4,���������CH4��Ũ���뷴Ӧʱ��Ĺ�ϵ��ͼ��ʾ��

(6)�ٴӷ�Ӧ��ʼ��ǡ�ôﵽƽ��ʱ��H��ƽ����Ӧ����v(H2)=____________��
��300��ʱ����Ӧ��ƽ�ⳣ��K=____________��
�۱����¶Ȳ��䣬��ƽ�����������ٳ���2molCO2��8molH2,���´ﵽƽ��ʱCH4��Ũ��__(�����)��
A.����0.8mo/L B.����1.6mo/L
C.0.8mol/L4)<1.6mol/L D.����1.6mol/L
(7)300��ʱ���������������1.6molCO2��2.0molH2��5.6molCH4��4.0molH2O(g).��v��___v��
(�>����<����=" )��
(8)��֪:200��ʱ���÷�Ӧ��ƽ�ⳣ��K=64.8L2��mol-2����H4____0(�>����<����=��)��
����3:���á�Na-CO2����ؽ�CO2���Ϊ�����ҹ�������Ա���Ƴ��Ŀɳ�硰Na-CO2��������Ʋ��Ͷ��̼����(MWCNT)Ϊ�缫���ϣ��ܷ�ӦΪ4Na+3CO2![]() 2Na2CO3+C���ŵ�ʱ�õ�ء����롱CO2���乤��ԭ����ͼ��ʾ:
2Na2CO3+C���ŵ�ʱ�õ�ء����롱CO2���乤��ԭ����ͼ��ʾ:

(9)�ٷŵ�ʱ�������ĵ缫��ӦʽΪ____________��
�������ɵ�Na2CO3��Cȫ�������ڵ缫���棬��ת��0.2mole-ʱ��������������Ϊ___g��