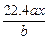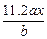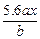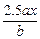题目内容
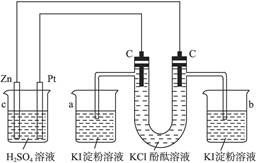
在150 mL 0.2 mol·L-1硫酸铜溶液中插入两个电极,通电电解(不考虑水的电解),则:
(1)若两极均为铜片,试说明电解过程中Cu2+浓度将怎样变化。
。
(2)若阳极为纯锌,阴极为铜片,阳极的电极反应式是 。
(3)如不考虑H+在阴极上放电,当电路中有0.04 mol e-通过时,阴极增重 g,阴极上的电极反应式是 。
(1)若两极均为铜片,试说明电解过程中Cu2+浓度将怎样变化。
。
(2)若阳极为纯锌,阴极为铜片,阳极的电极反应式是 。
(3)如不考虑H+在阴极上放电,当电路中有0.04 mol e-通过时,阴极增重 g,阴极上的电极反应式是 。
(1)不变化 (2)Zn-2e- Zn2+ (3)1.28Cu2++ 2e-
Zn2+ (3)1.28Cu2++ 2e- Cu
Cu
 Zn2+ (3)1.28Cu2++ 2e-
Zn2+ (3)1.28Cu2++ 2e- Cu
Cu(1)两个电极均为铜片时相当于电镀池。(2)纯锌作阳极时阳极为非惰性阳极,锌放电,电极反应式为Zn-2e- Zn2+。(3)阴极的电极反应式为Cu2++2e-
Zn2+。(3)阴极的电极反应式为Cu2++2e- Cu
Cu
2 mol 64
0.04 mol m(Cu)
m(Cu)="1.28" g
 Zn2+。(3)阴极的电极反应式为Cu2++2e-
Zn2+。(3)阴极的电极反应式为Cu2++2e- Cu
Cu2 mol 64
0.04 mol m(Cu)
m(Cu)="1.28" g

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
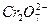 的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬的含量已低于排放标准。请回答下列问题:
的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬的含量已低于排放标准。请回答下列问题: