题目内容
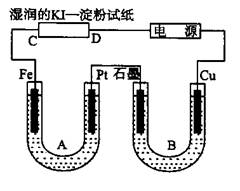
在20 ℃时,用石墨电极电解饱和硫酸铜溶液(阳极放出氧气),如有0.20 mol e-发生转移,试回答以下问题:
(1)在阴极发生什么反应?写出电极反应式,阴极得到铜的质量是多少?
(2)在阳极发生什么反应?写出电极反应式,阳极得到氧气的体积(标准状况)是多少?
(3)电解质溶液的pH发生了什么变化,为什么?
(4)如用铜片代替石墨作阳极,阳极发生什么反应?产物是什么?电解液的pH将如何变化?
(1)在阴极发生什么反应?写出电极反应式,阴极得到铜的质量是多少?
(2)在阳极发生什么反应?写出电极反应式,阳极得到氧气的体积(标准状况)是多少?
(3)电解质溶液的pH发生了什么变化,为什么?
(4)如用铜片代替石墨作阳极,阳极发生什么反应?产物是什么?电解液的pH将如何变化?
(1)Cu2++2e- Cu 6.4 g
Cu 6.4 g
(2)4OH--4e- 2H2O+O2↑ 1.12 L
2H2O+O2↑ 1.12 L
(3)pH变小,因为电解消耗水且同时生成H2SO4。
(4)Cu-2e- Cu2+ Cu2+ pH不变
Cu2+ Cu2+ pH不变
 Cu 6.4 g
Cu 6.4 g(2)4OH--4e-
 2H2O+O2↑ 1.12 L
2H2O+O2↑ 1.12 L(3)pH变小,因为电解消耗水且同时生成H2SO4。
(4)Cu-2e-
 Cu2+ Cu2+ pH不变
Cu2+ Cu2+ pH不变(1)Cu2++2e- Cu
Cu
2 mol 64
0.2 mol m(Cu)="6.4" g
(2)4OH--4e- 2H2O+O2↑
2H2O+O2↑
4 mol 22.4 L
0.2 mol V(O2)="1.12" L
(3)因为2CuSO4+2H2O 2Cu+2H2SO4+O2↑电解消耗了部分水,而且有H2SO4生成,所以pH变小。
2Cu+2H2SO4+O2↑电解消耗了部分水,而且有H2SO4生成,所以pH变小。
(4)铜片作阳极,则阳极反应:Cu-2e- Cu2+,pH不变。
Cu2+,pH不变。
 Cu
Cu2 mol 64
0.2 mol m(Cu)="6.4" g
(2)4OH--4e-
 2H2O+O2↑
2H2O+O2↑4 mol 22.4 L
0.2 mol V(O2)="1.12" L
(3)因为2CuSO4+2H2O
 2Cu+2H2SO4+O2↑电解消耗了部分水,而且有H2SO4生成,所以pH变小。
2Cu+2H2SO4+O2↑电解消耗了部分水,而且有H2SO4生成,所以pH变小。(4)铜片作阳极,则阳极反应:Cu-2e-
 Cu2+,pH不变。
Cu2+,pH不变。
练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
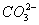 的浓度减小
的浓度减小
 Zn
Zn