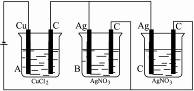
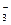题目内容
工业上为了处理含有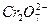 的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬的含量已低于排放标准。请回答下列问题:
的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬的含量已低于排放标准。请回答下列问题:
(1)两极发生的电极反应式为:阴极:______________;阳极:__________________。
(2)写出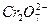 变为Cr3+的离子方程式:__________________________。
变为Cr3+的离子方程式:__________________________。
(3)工业废水由酸性变为碱性的原因是:___________________________。
(4)_________(填“能”或“不能”)改用石墨电极,原因是______________________。
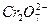 的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬的含量已低于排放标准。请回答下列问题:
的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬的含量已低于排放标准。请回答下列问题:(1)两极发生的电极反应式为:阴极:______________;阳极:__________________。
(2)写出
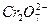 变为Cr3+的离子方程式:__________________________。
变为Cr3+的离子方程式:__________________________。(3)工业废水由酸性变为碱性的原因是:___________________________。
(4)_________(填“能”或“不能”)改用石墨电极,原因是______________________。
(1)2H++2e-====H2↑ Fe-2e-====Fe2+
(2)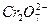 +6Fe2++14H+====2Cr3++6Fe3++7H2O
+6Fe2++14H+====2Cr3++6Fe3++7H2O
(3)H+不断放电,且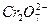 与Fe2+反应消耗Fe2+,使水的电离平衡被破坏,c(OH-)>c(H+)
与Fe2+反应消耗Fe2+,使水的电离平衡被破坏,c(OH-)>c(H+)
(4)不能 用石墨作电极至Fe2+生成,无法将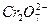 还原为Cr3+生成Cr(OH)3而除去
还原为Cr3+生成Cr(OH)3而除去
(2)
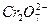 +6Fe2++14H+====2Cr3++6Fe3++7H2O
+6Fe2++14H+====2Cr3++6Fe3++7H2O(3)H+不断放电,且
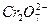 与Fe2+反应消耗Fe2+,使水的电离平衡被破坏,c(OH-)>c(H+)
与Fe2+反应消耗Fe2+,使水的电离平衡被破坏,c(OH-)>c(H+)(4)不能 用石墨作电极至Fe2+生成,无法将
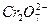 还原为Cr3+生成Cr(OH)3而除去
还原为Cr3+生成Cr(OH)3而除去用非惰性电极作阳极电解,铁会失电子,生成的Fe2+具有还原性,与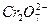 反应,且反应过程中产生OH-,而使水溶液由酸性变为碱性。
反应,且反应过程中产生OH-,而使水溶液由酸性变为碱性。
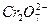 反应,且反应过程中产生OH-,而使水溶液由酸性变为碱性。
反应,且反应过程中产生OH-,而使水溶液由酸性变为碱性。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

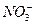 向阴极移动,K+向阳极移动,分别在对应的极上析出
向阴极移动,K+向阳极移动,分别在对应的极上析出