题目内容
下图所示,用石墨作电极进行电解,电解槽甲中盛AgNO3溶液,电解槽乙中盛有含二价金属G的氯化物溶液1 L,其物质的量浓度为0.1 mol·L-1,当通电一段时间后,电解槽甲中阴极增重0.27 g,乙中阴极增重0.14 g,则元素G的相对原子质量为( )
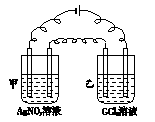

| A.112 | B.73 | C.64 | D.65 |
A
本题将电解池、AgNO3溶液电解发生反应的方程式、电极反应方程式等知识点综合于一题,考查考生运用化学基本概念和基本计算的技能解决化学问题的能力。由甲池阴极发生电极反应的方程式:Ag++e- Ag↓,可求出导线上通过电子的物质的量为:n(e-)=
Ag↓,可求出导线上通过电子的物质的量为:n(e-)=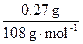 ="0.0025" mol,由于电路上通过的电子的物质的量相等,所以由乙池阴极电极反应方程式,可得:
="0.0025" mol,由于电路上通过的电子的物质的量相等,所以由乙池阴极电极反应方程式,可得:
G2++2e- G↓
G↓
2 Mr(G)
0.0025 mol 0.14 g
Mr(G)=112,A正确。
 Ag↓,可求出导线上通过电子的物质的量为:n(e-)=
Ag↓,可求出导线上通过电子的物质的量为:n(e-)=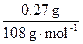 ="0.0025" mol,由于电路上通过的电子的物质的量相等,所以由乙池阴极电极反应方程式,可得:
="0.0025" mol,由于电路上通过的电子的物质的量相等,所以由乙池阴极电极反应方程式,可得:G2++2e-
 G↓
G↓2 Mr(G)
0.0025 mol 0.14 g
Mr(G)=112,A正确。

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
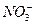 向阴极移动,K+向阳极移动,分别在对应的极上析出
向阴极移动,K+向阳极移动,分别在对应的极上析出