题目内容
【题目】化学变化是有条件的。某小组同学探究I-与金属阳离子的氧化还原反应,实验过程如下。
已知同浓度的稀溶液中氧化性:Ag+>Fe3+>Cu2+。

(1)根据实验I和Ⅱ,请回答下列问题。
①由“黄色立即加深”初步判断有I2生成,选择 ___(填试剂)进一步证实生成了I2。
②写出Fe3+与I-反应的离子方程式__,该条件下氧化性:Fe2+ __ I2(选填“>”或“<”)。
③实验Ⅱ的目的是____。
(2)实验Ⅳ中Cu2+与I-反应的离子方程式是___,甲同学得出氧化性:Cu2+ >I2。
(3)乙同学认为甲同学的结论不合理,分析原因:实验Ⅲ应有 I2生成,但却生成了AgI沉淀,因此推测实验Ⅳ中I2的生成,与Cul沉淀有关,故不能确定氧化性:Cu2+>I2,并用下图装置进行验证。
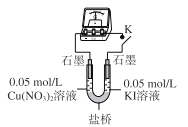
K闭合后,较长时间发现两侧溶液均无明显变化。乙同学为了进一步判断Cu2+和I2的氧化性强弱,将左侧电极改为Cu电极,并向右侧溶液中加入少量 ___(填试剂),发现指针偏转,且左侧溶液颜色加深,证明该条件下氧化性:Cu2+ __ I2(选填“>”或“<”)。
(4)该小组同学进一步分析认为,实验Ⅲ没有发生2Ag++ 2I-=2Ag+I2的反应,原因是生成AgI沉淀,反应物浓度迅速降低,不利于该反应进行;请分析实验Ⅳ发生氧化还原反应的原因是____。
(5)小组同学反思实验,反应体系中,各物质浓度对氧化还原反应是否发生都有一定的影响。
【答案】 淀粉溶液或CCl4 2Fe3++2I-=2Fe2++I2 > 对比实验排除了本实验条件下,I2的生成是由NO3-或溶液中的O2氧化得到 2Cu2++4I-=2CuI↓+I2 I2 < 2Cu2++2I-![]() 2Cu++ I2,由于Cu+与I-生成CuI沉淀,产物浓度迅速降低,促进反应进行
2Cu++ I2,由于Cu+与I-生成CuI沉淀,产物浓度迅速降低,促进反应进行
【解析】(1)①碘单质的检验可以用淀粉溶液也可以用四氯化碳溶液。②Fe3+具有氧化性,I-具有还原性,两者会发生氧化还原反应,由强制线弱的规律,很容易比较氧化性的关系。③对比实验,排除了本实验条件下,I2的生成可能是由NO3-或溶液中的O2氧化得到。
(2)Cu2+与I-发生氧化还原反应,由反应现象推出产物为I2,CuI,方程式为:2Cu2++4I-=2CuI↓+I2)。
(3)开始K闭合时,较长时间两侧溶液无明现象,说明Cu2+未能将I-氧化,后期更改电极,并向右侧加I2,指针偏转,左侧溶液加深,说明I2将Cu氧化成Cu2+,由此可说明氧化性: Cu2+< I2
(4)Cu+与I-生成CuI沉淀,产物浓度迅速降低,促进2Cu2++2I-![]() 2Cu++ I2反应进行。
2Cu++ I2反应进行。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案【题目】下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题.
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | C | N | O | F | Ne | |||
3 | Na | Al | P | S | Cl |
(1)单质的化学性质最不活沷的元素是;
(2)氧的原子结构示意图是;
(3)形成化合物种类最多的元素是;
(4)HF和H2O中,热稳定性较强的是;
(5)N和P中,原子半径较小的是;
(6)常温下,会在浓硫酸中发生钝化的金属是;
(7)元素最高价氧化物对应水化物中,碱性最强的是(填化学式),酸性最强的是(填“H2SO4”或“HClO4”);
(8)硫的一种氧化物可使品红溶液褪色,写出该氧化物的化学式 , 其中硫元素和氧元素的质量比m(S):m(O)= . (相对原子质量:S﹣32,O﹣16)
【题目】已知:H2(g)+Br2(l)=2HBr(g) H=-akJ/mol,蒸发1molBr2(l)需要吸收的能量为30kJ,其他数据如下表:
H2(g) | Br2(g) | HBr(g) | |
1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | b | 369 |
下列说法正确的是
A. 2HBr(g)=H2(g)+Br2(g)H=+akJ/mol
B. H2(g)的稳定性低于HBr(g)
C. Br2(g)=Br2(l) H=+30kJ/mol
D. b=272-a