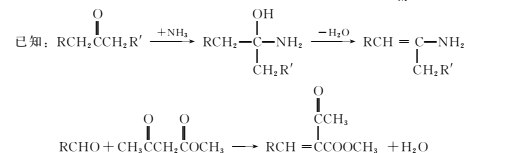
题目内容
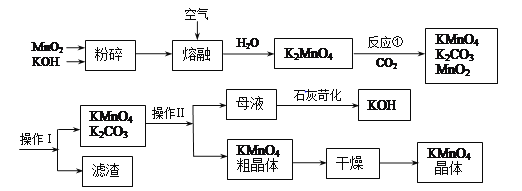
【题目】高锰酸钾是中学常用的试剂。工业上用软锰矿制备高锰酸钾流程如下。
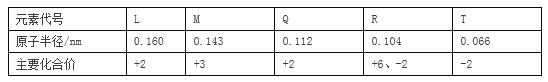
(1)铋酸钠(NaBiO3,不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋的还原产物为Bi3+,Mn的氧化产物为+7价),写出反应的离子方程式__________。
(2)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是________(填代号)。
a.84消毒液(NaClO溶液) b.双氧水 c.75%酒精 d.肥皂水
(3)上述流程中可以循环使用的物质有________、________(写化学式)。
(4)理论上(若不考虑物质循环与制备过程中的损失)1molMnO2可制得________molKMnO4。
(5)操作Ⅰ的名称是________;操作Ⅱ根据KMnO4和K2CO3两物质在溶解度上的差异,采用________(填操作步骤)、趁热过滤得到KMnO4粗晶体。
【答案】 2Mn2++5NaBiO3+14H+=2MnO4-+5Bi3++5Na++7H2O ab MnO2 KOH ![]() 过滤 蒸发结晶(或浓缩结晶)
过滤 蒸发结晶(或浓缩结晶)
【解析】分析:二氧化锰与氢氧化钾在空气中熔融,加水溶计算得出到K2MnO4溶液,通入二氧化碳得到KMnO4、MnO2、K2CO3,过滤除去滤渣(MnO2),滤液为KMnO4、K2CO3溶液,浓缩结晶,趁热过滤得到KMnO4晶体,滤液中含有K2CO3,在滤液中加氢氧化钙得到碳酸钙沉淀和KOH,以此解答。
(1)铋酸钠(不溶于水)在酸性溶液中与Mn2+反应生成MnO42-和Bi3+,则反应的离子方程式为: 2Mn2++5NaBiO3+14H+=2MnO4-+5Bi3++5Na++7H2O;
因此,本题正确答案是: 2Mn2++5NaBiO3+14H+=2MnO4-+5Bi3++5Na++7H2O;
(2) KMnO4有强氧化性,利用其强氧化性杀菌消毒,消毒原理与84消毒液、双氧水一样,因此,本题正确答案是:ab;
(3)根据流程分析可以知道:在开始的反应物和最终的生成物中都含有MnO2和KOH,所以二氧化锰和氢氧化钾能循环使用;
因此,本题正确答案是: MnO2;KOH;
(4)由2MnO2+4KOH+O2==2K2MnO4+2H2O可以知道最初的原料中1molMnO2恰好得到1molK2MnO4。由3K2MnO4+2CO2==2KMnO4+2K2CO3+MnO2知, 1molK2MnO4在反应中能得到![]() molKMnO4,
molKMnO4,
因此,本题正确答案是:![]() ;
;
(5)该操作是分离固体与溶液,是过滤操作, KMnO4和K2CO3在溶解性上不同,采用热的情况下用浓缩结晶的方式可分离,
因此,本题正确答案是: 过滤;蒸发结晶(或浓缩结晶)。

 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案