题目内容
【题目】下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题.
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | C | N | O | F | Ne | |||
3 | Na | Al | P | S | Cl |
(1)单质的化学性质最不活沷的元素是;
(2)氧的原子结构示意图是;
(3)形成化合物种类最多的元素是;
(4)HF和H2O中,热稳定性较强的是;
(5)N和P中,原子半径较小的是;
(6)常温下,会在浓硫酸中发生钝化的金属是;
(7)元素最高价氧化物对应水化物中,碱性最强的是(填化学式),酸性最强的是(填“H2SO4”或“HClO4”);
(8)硫的一种氧化物可使品红溶液褪色,写出该氧化物的化学式 , 其中硫元素和氧元素的质量比m(S):m(O)= . (相对原子质量:S﹣32,O﹣16)
【答案】
(1)Ne
(2)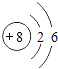
(3)C
(4)HF
(5)N
(6)Al
(7)NaOH; HClO4
(8)SO2;1:1
【解析】解:(1)稀有气体的化学性质最不活泼,Ne为稀有气体,故答案为:Ne;(2)O原子含有8个质子、8个核外电子,核外电子排布为:K层2个电子、L层6个电子,O的原子结构示意图为: 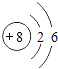 ,
,
故答案为: 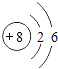 ;(3)有机物种类繁多,C是构成有机化合物的重要元素,因此形成化合物种类最多的元素是C,
;(3)有机物种类繁多,C是构成有机化合物的重要元素,因此形成化合物种类最多的元素是C,
故答案为:C;(4)非金属性:F>O,因此热稳定性:HF>H2O,因此HF和H2O中,热稳定性较强的是HF,
故答案为:HF;(5)同主族自上而下原子半径逐渐增大,N和P处于第ⅤA族,因此原子半径:P>N,
故答案为:N;(6)常温下,铝和铁会在浓硫酸中发生钝化,因此常温下,会在浓硫酸中发生钝化的金属是铝,
故答案为:Al;(7)元素的金属性越强,其最高价氧化物对应水化物的碱性越强,在题目所给元素中Na的金属性最强,因此元素最高价氧化物对应水化物中,碱性最强的是NaOH,
元素的非金属性越强,其最高价氧化物对应水化物的酸性越强(F、O除外),除去F、O,Cl的非金属性最强,因此酸性最强的是HClO4,
故答案为:HClO4;(8)二氧化硫可以漂白品红溶液,二氧化硫的化学式为SO2,硫元素和氧元素的质量比m(S):m(O)=32:16×2=1:1,
故答案为:SO2;1:1.
(1)稀有气体的化学性质最不活泼;(2)O原子含有8个质子、8个核外电子,核外电子排布为:K层2个电子、L层6个电子;(3)C是构成有机化合物的重要元素;(4)非金属性:F>O,因此热稳定性:HF>H2O;(5)同主族自上而下原子半径逐渐增大;(6)常温下,铝和铁会在浓硫酸中发生钝化;(7)元素的金属性越强,其最高价氧化物对应水化物的碱性越强,元素的非金属性越强,其最高价氧化物对应水化物的酸性越强(F、O除外);(8)二氧化硫可以漂白品红溶液.

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案