题目内容
15.V、W、X、Y、Z是原子序数依次递减的五种常见元素.X元素是地壳中含量最多的元素,Y、Z组成的气态化合物M的水溶液呈碱性,W的单质在X2中的燃烧产物可使品红溶液褪色,V是一种历史悠久、应用广泛的金属元素.请回答:(1)Y元素在周期表中的位置是第二周期第ⅤA族;
(2)由以上五种元素两两组合所形成的常见化合物中,有一种气体物质能与水反应生成气体且反应属于氧化还原反应,请写出该反应的化学方程式3NO2+H2O=2HNO3+NO.
(3)X、Y、Z三种元素可组成一种强酸U,M在适当条件下被U吸收生成一种盐.该盐的水溶液的pH小于7(填“大于”、“小于”或“等于”).原因是(用离子方程式表示)NH4++H2O?NH3.H2O+H+
(4)若将V金属投入到盐酸溶液中,生成了浅绿色溶液N.N的酸性溶液与双氧水反应的离子方程式:2Fe2++2H++H2O2=2Fe3++2H2O
(5)有人设想寻求合适的催化剂和电极材料,以Y2、Z2为电极反应物,以HCl-NH4Cl溶液为电解质溶液制造新型原电池,试写出该电池的正极电极反应式N2+8H++6e-=2NH4+,放电时溶液中H+移向正(填“正”或“负”)极.
分析 V、W、X、Y、Z是原子序数依次递减的五种常见元素.X元素是地壳中含量最多的元素,则X为O元素;Y、Z组成的气态化合物M的水溶液呈碱性,可推知Y为N元素、Z为H元素,M为NH3;W的单质在X2中燃烧产物可使品红溶液褪色,可推知W为S元素;V是一种历史悠久、应用最广泛的金属元素,则V为Fe元素,据此解答.
解答 解:V、W、X、Y、Z是原子序数依次递减的五种常见元素.X元素是地壳中含量最多的元素,则X为O元素;Y、Z组成的气态化合物M的水溶液呈碱性,可推知Y为N元素、Z为H元素,M为NH3;W的单质在X2中燃烧产物可使品红溶液褪色,可推知W为S元素;V是一种历史悠久、应用最广泛的金属元素,则V为Fe元素,
(1)Y为N元素,在周期表中的位置是:第二周期第ⅤA族
故答案为:第二周期第ⅤA族;
(2)由以上五种元素两两组合所形成的化合物中,有一种物质能与水反应生成气体且反应属于氧化还原反应,应是二氧化氮与水反应生成硝酸与NO,该反应的化学方程式为:3NO2+H2O=2HNO3+NO,
故答案为:3NO2+H2O=2HNO3+NO;
(3)O、N、H三种元素可组成一种强酸U为HNO3,氨气在适当条件下被HNO3吸收生成NH4NO3,该盐的水溶液中NH4+离子水解:NH4++H2O?NH3.H2O+H+,破坏水的电离平衡,溶液呈酸性,溶液pH小于7,
故答案为:小于;NH4++H2O?NH3.H2O+H+;
(4)将Fe投入到盐酸溶液中,生成了浅绿色FeCl2溶液,双氧水具有强氧化性,酸性条件下将亚铁离子氧化为铁离子,同时生成水,FeCl2的酸性溶液与双氧水反应的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O,
故答案为:2Fe2++2H++H2O2=2Fe3++2H2O;
(5)以N2、H2为电极反应物,以HCl-NH4Cl溶液为电解质溶液制造新型燃料电池,正极发生还原反应,氮气在正极获得电子,酸性条件下生成NH4+,该电池的正极电极反应式为:N2+8H++6e-=2NH4+,放电时溶液中H+向正极移动,
故答案为:N2+8H++6e-=2NH4+;正.
点评 本题考查结构性质位置关系应用,题目难度中等,推断元素的种类是关键,注意电极反应式的书写.

| A. | 所含共用电子对数为($\frac{a}{7}+1$)NA | B. | 所含碳氢键数目为$\frac{a{N}_{A}}{7}$ | ||
| C. | 燃烧时消耗的O2一定是$\frac{33.6a}{14}$L | D. | 所含原子总数为$\frac{a{N}_{A}}{14}$ |
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
| A. | 苯、油脂均不能使酸性KMnO4溶液褪色 | |
| B. | C4H10有三种同分异构体 | |
| C. | 氨基酸、淀粉均属于高分子化合物 | |
| D. | 乙烯和甲烷可用溴的四氯化碳溶液鉴别 |
| A. | 某芳香烃的分子式为C10H14,它不能使溴水褪色,但可使酸性KMnO4溶液褪色,且分子结构中只有一个烷基,符合条件的烃有3种 | |
| B. | 当溶液中的氨基酸主要以两性离子的形态存在时,它在水中的溶解度最小,可以形成晶体析出.不同的氨基酸出现这种情况的pH各不相同,利用这一差别,可以通过调节溶液pH分离某些氨基酸 | |
| C. | 有机硅聚醚 (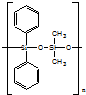 )可由单体 )可由单体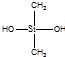 和 和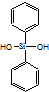 缩聚而成 缩聚而成 | |
| D. | 等质量的甲醇、甲醛、二甲醚完全燃烧时的耗氧量依次递增 |
