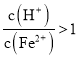题目内容
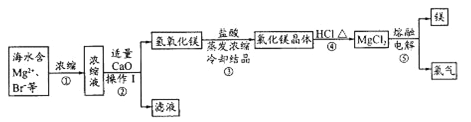
【题目】海水资源的开发和利用是当前科学研究的一项重要任务。下图是实验室模拟镁开发的流程图:
根据上述流程图,回答下列问题:
(1)操作I的名称是________。
(2)步骤中②反应的化学方程式为________。
(3)步骤④中加热时通入HCl气流的作用是__________。
(4)步骤⑤的离子反应方程式为___________。
(5)有人提出步骤⑤的副产物可在流程中再利用以提高海水的综合利用率。若A为上述流程中的某组分,则A、B分别为_____________。
【答案】过滤 CaO+H2O=Ca(OH)2 MgBr2+ Ca(OH)2= Mg(OH)2↓+CaBr2(MgBr2也可是MgCl2、MgSO4等) 增大HCl浓度抑制MgCl2的水解 Mg2++2Cl-![]() Mg+Cl2↑ 滤液(或浓缩液) Br2
Mg+Cl2↑ 滤液(或浓缩液) Br2
【解析】
海水中主要有Na+,Cl-,Mg2+,Br-,SO42-等离子,蒸发浓缩后取浓缩液加CaO后会产生Mg(OH)2沉淀,进行过滤,滤液中当然含有Na+,Cl-,Br-,SO42-等离子。取所得的Mg(OH)2加HCl后进行浓缩结晶得到MgCl2晶体。再在HCl氛围中加热使其失去结晶水,得到MgCl2后,再进行电解得到Mg和Cl2。
(1)将固体和液体分开采用过滤。
(2)步骤中②反应的化学方程式为CaO+H2O=Ca(OH)2 MgBr2+ Ca(OH)2= Mg(OH)2↓+CaBr2。
(3)步骤④中加热时通入HCl增大HCl浓度,在HCl氛围中,抑制MgCl2的水解,不能直接加热,否则MgCl2晶体会发生水解得到Mg(OH)2。
(4)步骤⑤的离子反应方程式为Mg2++2Cl-![]() Mg+Cl2↑,在熔融状态下MgCl2会电离出离子,所以要拆成离子形式。
Mg+Cl2↑,在熔融状态下MgCl2会电离出离子,所以要拆成离子形式。
(5)上述流程中除了Mg,还能与Cl2反应的只有Br-,存在于溶液中,通过Cl2置换,可以回收利用Br2。

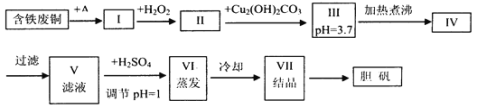
【题目】胆矾是一种常见的化合物,工业上它也是一种制取其它含铜化合物的原料,现有废铜(主要杂质为Fe)来制备胆矾。有人设计了如下流程:
pH值控制可参考下列数据
物质 | 开始沉淀时的pH值 | 完全沉淀时的pH值 |
氢氧化铁 | 2.7 | 3.7 |
氢氧化亚铁 | 7.6 | 9.6 |
氢氧化铜 | 5.2 | 6.4 |
请根据上述流程回答下列问题:
(1)A可选用__(填字母)
a.稀H2SO4 b.浓H2SO4、加热 c.浓FeCl3溶液 d.浓HNO3
(2)Ⅰ中加H2O2的目的__。
(3)Ⅱ中加Cu2(OH)2CO3的目的是__,其优点是__。
(4)Ⅲ加热煮沸时发生的化学反应的离子方程式为__。
(5)V中加H2SO4调节pH=1是为了__。